题目内容
保险粉(Na2S2O4)有极强的还原性,遇热水或潮湿空气会分解发热,但在碱性环境下较稳定。回答下列问题:
(1)二氧化硫的制备
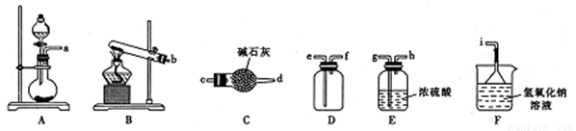
①二氧化硫的发生装置可以选择上图中的_____________(填大写字母),反应的化学方程式为______________________。
②欲收集一瓶干燥的二氧化硫,选择上图中的装置,其接口的连接顺序为发生装置→__________________→→______→______→ ____________。(按气流方向,用小写字母表示)
(2)保险粉的制备
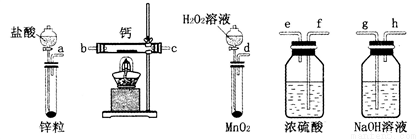
在35-45℃下,将SO2气体通入锌粉一水悬浮液中(如图),使之发生反应生成ZnS2O4;待反应完全后,移走恒温水浴装置并冷却至室温,向三颈烧瓶中加人18%的NaOH溶液,使之发生反应生成Na2S2O4和Zn(OH)2;经一系列操作后得到无水Na2S2O4样品。

①实验开始时,应先关闭止水夹K3、打开K1和K2,通入一段时间SO2,其原因是__________。
②通过观察_________________,调节止水夹K1来控制SO2的流速。
③由ZnS2O4生成Na2S2O4的化学方程式为_____________。
(3)称取2.0gNa2S2O4样品溶于冷水中,配成100mL吐溶液,取出10mL该溶液于试管中,用0 .10 mol/L的KMnO4溶液滴定(滴定至终点时产物为Na2SO4和MnSO4),重复上述操作2次,平均消耗溶液12.00mL。则该样品中Na2S2O4的质量分数为_______(杂质不参与反应)。
练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目



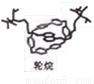
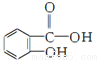 ,俗名水杨酸。水杨酸属于( )
,俗名水杨酸。水杨酸属于( )