��Ŀ����
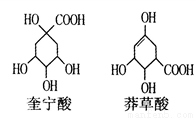
��������������������λ��ѧ�����о������ӻ����������ϳɡ����2016��ŵ������ѧ����������һ�ַ��ӻ����ġ����ӡ����ϳ�����Ļ���ԭ����CH2C12����ϩ���촼����������˵������ȷ����
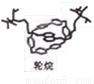
A. CH2C12������ͬ���칹��
B. ��ϩ��ʹ��ˮ��ɫ
C. �촼��һ���������������ᷢ��������Ӧ
D. �����������������������»ᷢ���ӳɷ�Ӧ���ɻ�����
��ϰ��ϵ�д�
 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
�����Ŀ

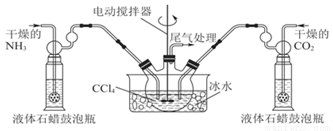
 H2NCOONH4 ��H <0
H2NCOONH4 ��H <0 

 CO2(g)+3H2(g) ��H1=+49.4 kJ/mol��Ӧ��״��ֽ����⣺CH3OH(g)
CO2(g)+3H2(g) ��H1=+49.4 kJ/mol��Ӧ��״��ֽ����⣺CH3OH(g)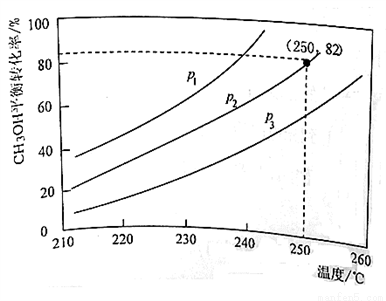
 Fe(s)+CO2(g)��K=0.5������1L�ܱ������м���0.04mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)��ת����Ϊ50%����x=_______��
Fe(s)+CO2(g)��K=0.5������1L�ܱ������м���0.04mol FeO(s)����ͨ��xmolCO��t��ʱ��Ӧ�ﵽƽ�⡣��ʱFeO(s)��ת����Ϊ50%����x=_______��