题目内容
【题目】取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1 molL-1的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
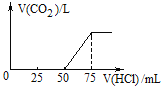
(1)A溶液中的溶质为_________(化学式),其物质的量之比是_______。
(2)通入CO2气体体积__________________(标准状况)。
(3)NaOH溶液的物质的量浓度______________________。
【答案】 NaOH、Na2CO3 1:1 56 mL 0.075mol/L
【解析】CO2与 NaOH溶液反应有如下两种“边界”情况:
![]() ①
①![]() ②故反应后溶液中溶质的成分可有如下四种可能:Na2CO3 和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
②故反应后溶液中溶质的成分可有如下四种可能:Na2CO3 和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:![]() ③
③![]() ④并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等。若溶液中还有氢氧化钠,则首先发生反应:
④并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等。若溶液中还有氢氧化钠,则首先发生反应:![]() ⑤;设反应产生CO2之前消耗盐酸的体积为V1,从开始产生CO2至反应结束消耗盐酸的体积为V2。将各种反应的情况总结如表:
⑤;设反应产生CO2之前消耗盐酸的体积为V1,从开始产生CO2至反应结束消耗盐酸的体积为V2。将各种反应的情况总结如表:
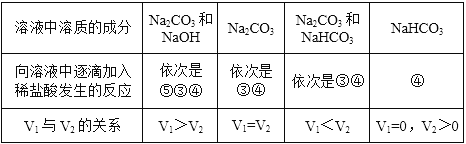
(1)由图像可知V1=50mL、V2=25mL ,则V1 >V2,符合上述表中第一种情况,据此判断A溶液中溶质的成分是NaOH和Na2CO3,根据上面⑤③④三个化学方程式可知,![]() 。答案为:NaOH、Na2CO3。
。答案为:NaOH、Na2CO3。
1:1
(2)![]() 发生的反应为
发生的反应为![]() ,刚好把通入的CO2又释放出来,所以n( HCl)=n(CO2),
,刚好把通入的CO2又释放出来,所以n( HCl)=n(CO2),![]() ,因此
,因此![]() 。答案为:56 mL。
。答案为:56 mL。
(3)当加入盐酸75mL时,溶液的溶质为NaCl,此时![]() ,所以
,所以![]() ,
,![]() 。答案为:0.075mol/L
。答案为:0.075mol/L

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目