题目内容
(2008?广东)盐酸、醋酸和碳酸氢钠是生活中常见的物质.下列表述正确的是( )
分析:A、碳酸钠是强碱弱酸盐能水解;
B、根据物料守恒和电荷守恒判断;
C、醋酸钠是强碱弱酸盐,能发生水解,根据电荷守恒和物料守恒判断各种离子浓度之间的关系;
D、醋酸是弱酸,氢离子浓度小于醋酸浓度,根据醋酸和盐酸的物质的量确定消耗氢氧化钠的量.
B、根据物料守恒和电荷守恒判断;
C、醋酸钠是强碱弱酸盐,能发生水解,根据电荷守恒和物料守恒判断各种离子浓度之间的关系;
D、醋酸是弱酸,氢离子浓度小于醋酸浓度,根据醋酸和盐酸的物质的量确定消耗氢氧化钠的量.
解答:解:A、在NaHCO3溶液中加入与其等物质的量的NaOH,碳酸氢钠和氢氧化钠恰好反应生成碳酸钠,碳酸钠是强碱弱酸盐能水解,碳酸根离子水解生成碳酸氢根离子,碳酸氢根离子水解生成碳酸,导致溶液中阴离子含有碳酸根离子、氢氧根离子、碳酸氢根离子,故A错误;
B、碳酸氢钠溶液中根据物料守恒知,C(Na+)=c (H2CO3)+c(HCO3-)+c(CO32-),根据电荷守恒知
C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-),所以c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故B错误;
C、反应后生成醋酸钠,醋酸钠是强碱弱酸盐能水解,醋酸根离子水解导致钠离子浓度大于醋酸根离子浓度,溶液呈碱性,所以氢氧根离子浓度大于氢离子浓度,醋酸钠以电离为主水解为次,所以各种离子浓度关系为c(Na+)>c(CH3COO-)>cOH-)>c(H+),故C正确;
D、氯化氢是强电解质,醋酸是弱电解质,PH值相同的盐酸和醋酸,醋酸的浓度远远大于盐酸,所以等体积的盐酸和醋酸,醋酸的物质的量远远大于盐酸的物质的量,中和体积与pH都相同的HCl溶液和CH3COOH溶液,所消耗的NaOH醋酸的多,盐酸的少,故D错误;
故选C.
B、碳酸氢钠溶液中根据物料守恒知,C(Na+)=c (H2CO3)+c(HCO3-)+c(CO32-),根据电荷守恒知
C(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-),所以c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故B错误;
C、反应后生成醋酸钠,醋酸钠是强碱弱酸盐能水解,醋酸根离子水解导致钠离子浓度大于醋酸根离子浓度,溶液呈碱性,所以氢氧根离子浓度大于氢离子浓度,醋酸钠以电离为主水解为次,所以各种离子浓度关系为c(Na+)>c(CH3COO-)>cOH-)>c(H+),故C正确;
D、氯化氢是强电解质,醋酸是弱电解质,PH值相同的盐酸和醋酸,醋酸的浓度远远大于盐酸,所以等体积的盐酸和醋酸,醋酸的物质的量远远大于盐酸的物质的量,中和体积与pH都相同的HCl溶液和CH3COOH溶液,所消耗的NaOH醋酸的多,盐酸的少,故D错误;
故选C.
点评:本题考查了离子浓度大小的比较,难度较大,能运用物料守恒和电荷守恒是解本题的关键.

练习册系列答案
相关题目
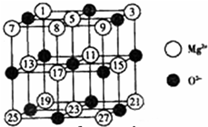 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.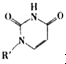 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: