题目内容
(2008?广东)铜在自然界存在于多种矿石中,如:
①上表所列铜化合物中,铜的质量百分含量最高的是
②工业上以黄铜矿为原料.采用火法溶炼工艺生产铜.该工艺的中间过程会发生反应:2Cu2O+Cu2S
6Cu+SO2↑,反应的氧化剂是
③SO2尾气直接排放到大气中造成环境污染的后果是
④黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.请简述粗铜电解得到精铜的原理:
⑤下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3?Cu(OH)2 |
Cu2S
Cu2S
.②工业上以黄铜矿为原料.采用火法溶炼工艺生产铜.该工艺的中间过程会发生反应:2Cu2O+Cu2S
| ||
Cu2O,Cu2S
Cu2O,Cu2S
.③SO2尾气直接排放到大气中造成环境污染的后果是
二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨
二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨
;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称硫酸,硫酸铵.
硫酸,硫酸铵.
.④黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.请简述粗铜电解得到精铜的原理:
粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
.⑤下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是
AD
AD
(填字母).| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
分析:①铜化合物中,铜的质量百分含量=
×100%,据此计算.
②根据元素的化合价变化判断,得电子化合价降低的物质是氧化剂.
③二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;二氧化硫是酸性氧化物,所以能用碱液吸收;二氧化硫能溶于水,且能和水反应生成酸.
④根据电镀原理分析,电镀时,粗铜作阳极,纯铜作阴极,电解质溶液为含有铜离子的盐溶液,阳极上发生氧化反应,阴极上得电子发生还原反应.
⑤根据各物质的性质分析.
| 铜的原子量×原子个数 |
| 分子量 |
②根据元素的化合价变化判断,得电子化合价降低的物质是氧化剂.
③二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;二氧化硫是酸性氧化物,所以能用碱液吸收;二氧化硫能溶于水,且能和水反应生成酸.
④根据电镀原理分析,电镀时,粗铜作阳极,纯铜作阴极,电解质溶液为含有铜离子的盐溶液,阳极上发生氧化反应,阴极上得电子发生还原反应.
⑤根据各物质的性质分析.
解答:解:(1)铜化合物中,铜的质量百分含量=
×100%,
黄铜矿中铜的含量=
×100%=35%;
斑铜矿中铜的含量=
×100%=63%;
辉铜矿中铜的含量=
×100%=80%;
孔雀石中铜的含量=
×100%=58%
所以铜的质量百分含量最高的是Cu2S.
故答案为:Cu2S.
(2)2Cu2O+Cu2S
6Cu+SO2↑,该反应中铜的化合价由+1价变为0价,铜元素在该反应中得电子化合价降低,所以该反应中的氧化剂是Cu2O,Cu2S.
故答案为:Cu2O,Cu2S.
(3)二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;二氧化硫能溶于水,且能和水反应生成亚硫酸,亚硫酸能被氧化成硫酸,二氧化硫是酸性氧化物,所以能用碱液吸收生成盐,如硫酸铵.
故答案为:二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;硫酸,硫酸铵.
(4)粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
故答案为:粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
(5)A、Ⅰ铜绿的主成分是碱式碳酸铜,故正确;Ⅱ碱式碳酸铜能和强酸反应生成盐和水、二氧化碳,故正确;碱式碳酸铜是弱酸盐能和强酸反应,所以二者有因果关系,故A正确.
B、Ⅰ铜是不活泼金属,所以其表面不易形成致密的氧化膜,故错误;Ⅱ常温下,铜和浓硫酸不反应,所以铜容器可以盛放浓硫酸,故正确;二者没有、因果关系,所以B错误.
C、Ⅰ铁的金属性比铜的金属性强,所以铁比铜活泼,故正确;Ⅱ在铜板上的铁钉在潮湿空气中易形成原电池,所以易生锈,故错误;二者有因果关系,所以C错误.
D、Ⅰ蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是化学变化,故错误;硫酸铜是重金属盐,能使蛋白质变性,所以溶液可用作游泳池的消毒剂,故正确;二者没有因果关系,所以D正确.
故选AD.
| 铜的原子量×原子个数 |
| 分子量 |
黄铜矿中铜的含量=
| 64 |
| 64+56+32×2 |
斑铜矿中铜的含量=
| 64×5 |
| 64×5+56+32×4 |
辉铜矿中铜的含量=
| 64×2 |
| 64×2+32 |
孔雀石中铜的含量=
| 64×2 |
| 64×2+12+16×5+1×2 |
所以铜的质量百分含量最高的是Cu2S.
故答案为:Cu2S.
(2)2Cu2O+Cu2S
| ||
故答案为:Cu2O,Cu2S.
(3)二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;二氧化硫能溶于水,且能和水反应生成亚硫酸,亚硫酸能被氧化成硫酸,二氧化硫是酸性氧化物,所以能用碱液吸收生成盐,如硫酸铵.
故答案为:二氧化硫是有毒气体,二氧化硫溶于水后形成酸性溶液,随雨水降下,就可能形成酸雨;硫酸,硫酸铵.
(4)粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
故答案为:粗铜电解得到精铜的原理:电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液.阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu 2+进入溶液中Cu-e-═Cu 2+;阴极上发生还原反应,Cu 2+得到电子在阴极上析出Cu单质,Cu 2++e-═Cu,从而达到精制Cu的目的.
(5)A、Ⅰ铜绿的主成分是碱式碳酸铜,故正确;Ⅱ碱式碳酸铜能和强酸反应生成盐和水、二氧化碳,故正确;碱式碳酸铜是弱酸盐能和强酸反应,所以二者有因果关系,故A正确.
B、Ⅰ铜是不活泼金属,所以其表面不易形成致密的氧化膜,故错误;Ⅱ常温下,铜和浓硫酸不反应,所以铜容器可以盛放浓硫酸,故正确;二者没有、因果关系,所以B错误.
C、Ⅰ铁的金属性比铜的金属性强,所以铁比铜活泼,故正确;Ⅱ在铜板上的铁钉在潮湿空气中易形成原电池,所以易生锈,故错误;二者有因果关系,所以C错误.
D、Ⅰ蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是化学变化,故错误;硫酸铜是重金属盐,能使蛋白质变性,所以溶液可用作游泳池的消毒剂,故正确;二者没有因果关系,所以D正确.
故选AD.
点评:本题考查了质量分数的计算、氧化剂的判断、电镀原理等知识点,难度不大,注意基础知识的积累.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
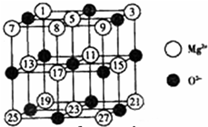 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.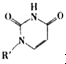 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: