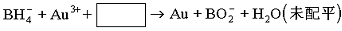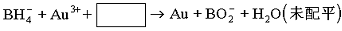题目内容
NaBH4作为还原剂,在有机化学中有极为广泛的用途。 (1)NaBH4极易溶解于水并与水作用产生H2,反应后硼元素以![]() 形式存在于溶液中,此反应的离子方程式为______________________________________________________。
形式存在于溶液中,此反应的离子方程式为______________________________________________________。
(2)该反应与溶液酸碱度有关,pH越小,反应速率越____________,其原因是__________________________。
(3)NaBH4可使许多金属离子还原为金属单质,例如它们可以使含有金离子(Au3+)的废液中Au3+还原(碱性条件,此时硼仍以![]() 形式存在),离子方程式__________________________。
形式存在),离子方程式__________________________。
解析:在NaBH4中B为+3价,H为-1价,故NaBH4与H2O反应发生的是氢元素的归中反应,故有H2放出,同时生成NaBO2。本反应实质上是H+与![]() 的反应,故pH越小,c(H+)越大,反应速率越大。
的反应,故pH越小,c(H+)越大,反应速率越大。
FeS+2H+====Fe2++H2S↑。
答案:(1)![]() +2H2O====
+2H2O====![]() +4H2↑
+4H2↑
(2)快 实质是H+与![]() 的反应 (3)3
的反应 (3)3![]() +8Au3++24OH-====8Au+
+8Au3++24OH-====8Au+![]() +18H2O
+18H2O

练习册系列答案
相关题目