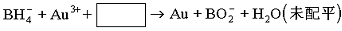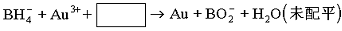题目内容
NaBH4作为还原剂,在有机化学合成中有极广泛的应用。(1)NaBH4极易溶解于水,并与水反应产生H2,反应后硼以![]() 形式存在,写出反应的离子方程式___________________________________。
形式存在,写出反应的离子方程式___________________________________。
(2)溶液的酸性越强,NaBH4与水的反应速率越______________ (填“快”或“慢”)。
(3)NaBH4可使许多金属离子还原为金属原子,例如可使含有金离子(Au3+) 的废液中的Au3+还原,其反应的离子方程式是_________________________________________________。
解析:本题根据信息书写离子方程式,是考查学生自学能力很好的题型,它既能看出学生对所学知识的掌握程度,又能体现学生接受新知识的能力。根据题给信息,NaBH4是还原剂,且与水反应产生H2,反应后硼以![]() 形式存在,不难推知水是氧化刘,沿着这条思路可写出:
形式存在,不难推知水是氧化刘,沿着这条思路可写出:![]() +2H2O====
+2H2O====![]() +4H2↑。
+4H2↑。
再根据(1)中可知,水是氧化剂,且电离出来的氢离子浓度小,若c(H+)大,可加快反应速率。由(1)和(2)的回答可知,在中性或酸性溶液中,![]() 与H2O能剧烈反应,为了抑制它们之间的反应,促使
与H2O能剧烈反应,为了抑制它们之间的反应,促使![]() 与Au3+反应,显而易见,只有在碱性条件下进行。即
与Au3+反应,显而易见,只有在碱性条件下进行。即
8Au3++![]() +24 OH-====8Au+
+24 OH-====8Au+![]() +18H2O,
+18H2O,
注意不要错写成:8Au3++![]() +9H2O====8Au+3H3BO3+21 OH-。
+9H2O====8Au+3H3BO3+21 OH-。
答案:(1) ![]() +2H2O====
+2H2O====![]() +4H2↑ (2)快
+4H2↑ (2)快
(3)8Au3++![]() +24 OH-====8Au+
+24 OH-====8Au+![]() +18H2O
+18H2O

练习册系列答案
相关题目