题目内容
(17分)美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下: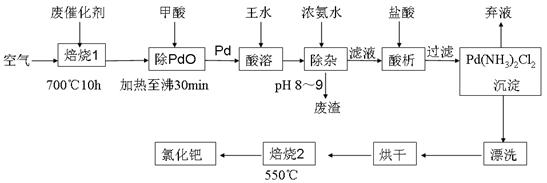
(1)甲酸还原氧化钯的化学方程式为 。
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式)。
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
(4)钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯的适宜条件是:反应温度为 ,反应时间约为 ,含钯的样品与王水的质量比为 。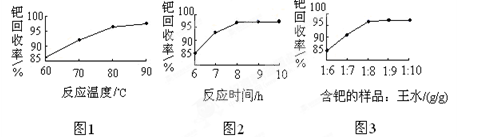
(5)700℃“焙烧1”的目的是 , 550℃“焙烧2”的目的是 。
(1)PdO+HCOOH Pd+CO2↑+H2O;(2)Fe(OH)3;(3)①NO;②H2PdCl4;(4)80~90℃;8h;1:8;(5)除去活性炭及有机物,脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”]
Pd+CO2↑+H2O;(2)Fe(OH)3;(3)①NO;②H2PdCl4;(4)80~90℃;8h;1:8;(5)除去活性炭及有机物,脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”]
解析

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
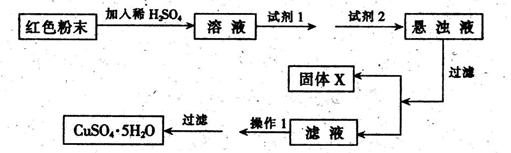
试回答:①试剂1为___ _,试剂2为 (填字母)。
②固体X的化学式为____,③操作I为_ 。
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 _? _ |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤, 加入足量? | ? | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④ 离子 |
(3)为进一步确定实验I的产物,设计定量实验方案,如图所示:
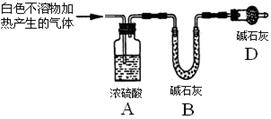
称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式 。
(4)用必要的语言文字叙述并结合方程式说明为什么碳酸氢钠溶液能和镁反应生成氢气?
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为_____________________________________。
(2)实验①的目的是_________________________________________________。
实验中滴加FeCl3溶液的目的是_______________________________________。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是_______________________(用实验中所提供的几种试剂)。
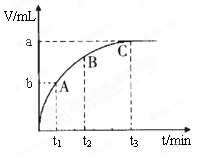
(4)某同学在50 mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如下图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______。
化学与生活、社会密切相关。下列说法不正确的是( )
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.提倡人们购物时不用塑料袋,是为了防止白色污染 |
化学与生活密切相关,下列说法不正确的是
| A.我国从上世纪80年代末开始逐步改用碘酸钾加工碘盐 |
| B.维生素C的其中一种功效是能将Fe3+还原成 Fe2+,促进人体对铁的吸收,有助于治疗缺铁性贫血 |
| C.汽车尾气排放是雾霾天气形成的一个原因,三元催化净化法的主要反应之一是2NO+2CO=N2+2CO2 |
| D.随着科技的发展,实现化石燃料高效清洁利用后,就无需开发新能源 |