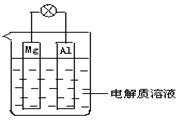
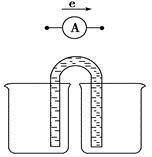
题目内容
(8分)某研究小组对铁生锈进行研究: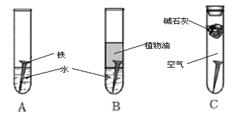
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母)。
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为: ;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是( )
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: 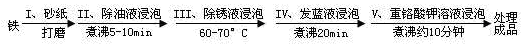
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
(8分,每空2分)
(1)A (2)O2+2 H2O+4e-= 4 OH-
(3)C (4)铁制品表面有红色固体析出
解析试题分析:(1)铁生锈需要O2和H2O,所以A中铁钉最容易生锈。
(2)H2O为中性,所以铁钉生锈时正极反应方程式为:O2+2 H2O+4e-= 4 OH-
(3)为防止铁生锈,应在铁钉表面镀上的金属的活泼性大于铁,形成原电池时,铁做阴极被保护,故C项正确。
(4)如果成品不合格,铁与硫酸铜溶液接触,发生铁与硫酸铜的置换反应,生成铜和硫酸亚铁,所以一段时间将观察到的现象为:铁制品表面有红色固体析出。
考点:本题考查原电池原理、铁生锈的原理及铁的防护。

研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )
| A.正极反应式:Ag+Cl--e-="AgCl" |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
| A.正极附近的SO42―离子浓度逐渐增大 |
| B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 |
| D.铜片上有H2逸出 |
(10分)
(1)铅蓄电池中,作负极材料的金属在元素周期表中的位置是________________,写出其正极的电极反应式______________________________________________________;
(2)汽车尾气分析仪对 CO 的分析 以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2- 可以在固体介质中自由移动。
下列说法错误的是___________________。
| A.负极的电极反应式为:CO+O2-―2e=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
【选修2化学与技术】(20分)
20-I(6分)下列有关叙述正确的是
| A.碱性锌锰电池中,MnO2是催化剂 | B.银锌纽扣电池工作时,Ag2O被还原为Ag |
| C.放电时,铅酸蓄电池中硫酸浓度不断增大 | D.电镀时,待镀的金属制品表面发生还原反应 |

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为____________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)