题目内容
(1)如下图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为: ___;
②电解质溶液为NaOH溶液时,灯泡______(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的电极反应式为:_______________;
Al电极上发生反应的电极反应式为:_______________;
b.若灯泡不亮,其理由为:________________________。
(2)原电池原理的应用之一是可以设计原电池。请利用反应“Cu+2Fe3+ =2Fe2+ +Cu2+ ”设制一个原电池(正极材料用碳棒)则该电池的负极材料是__________,若导线上转移电子1.5 mol,则溶解铜的质量是__________。另外的重要应用是实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液。其作用是: ______________________________。
(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为:______________________________。
(1)①2H+ + 2e- = H2↑;
②亮 a. 6H2O + 6e- = 6OH- + 3H2↑;2Al – 6e- + 8OH- =2AlO2- + 4H2O。
(2)Cu;48g;形成了Zn—Cu原电池,加快了化学反应的速率(注:必须强调形成Zn—Cu原电池,否则不得分);(3)H2 +2 OH- - 2e-=2H2O
解析试题分析:(1)①分析题给装置图,当电解质溶液为稀H2SO4时上述装置中灯泡亮,则形成原电池,镁较活泼,作原电池的负极,Al片作原电池的正极,电极反应式:2H+ + 2e- = H2↑;②电解质溶液为NaOH溶液时,Al片作负极,Mg片作正极,灯光亮,Mg电极上发生的电极反应式为a. 6H2O + 6e- = 6OH- + 3H2↑;Al电极上发生反应的电极反应式为:2Al – 6e- + 8OH- =2AlO2- + 4H2O;(2)结合Cu+2Fe3+ =2Fe2+ +Cu2+知,铜片发生氧化反应,负极材料是Cu片,电极反应式为Cu-2e- =Cu2+ ,若导线上转移电子1.5 mol,则溶解铜的质量是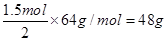 ,实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液的作用是形成了Zn—Cu原电池,加快了化学反应的速率;(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为H2 +2 OH- - 2e-=2H2O。
,实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液的作用是形成了Zn—Cu原电池,加快了化学反应的速率;(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为H2 +2 OH- - 2e-=2H2O。
考点:考查原电池原理、燃料电池。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案如图为蕃茄电池,下列说法正确的是( ) 
| A.一段时间后,锌片质量会变小 | B.铜电极附近会出现蓝色 |
| C.电子由铜通过导线流向锌 | D.锌电极是该电池的正极 |
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-= H2↑+2OH- |



 为电流表)。请回答:
为电流表)。请回答:

