题目内容
【题目】A、B是两种有刺激性气味气体。试根据下列实验事实填空。
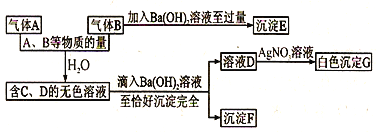
(1)写出C~F各物质的化学式: C______,D________,E_______,F_______。
(2)写出A、B跟水反应的离子方程式_________________________________。
【答案】 H2SO4 HCl BaSO3 BaSO4 Cl+SO+ 2HO = 4H+SOˉ+2Clˉ
【解析】(1)A、B是两种有刺激性气味的气体,B和氢氧化钡反应生成沉淀E,说明B是酸性氧化物,且B有刺激性气味,所以B是二氧化硫,沉淀E是亚硫酸钡;溶液D和硝酸银反应生成白色沉淀,说明D中含有氯离子,沉淀G是氯化银,所以A含有氯元素,A是刺激性气体,且能和二氧化硫反应,所以A是氯气。氯气、二氧化硫和水反应生成硫酸和盐酸,硫酸、盐酸和氢氧化钡反应生成硫酸钡和氯化钡,所以F是硫酸钡,D是盐酸。答案:C化学式为:H2SO4;D化学式为:HCl;E化学式为:BaSO3;F化学式为:BaSO4。
(2)由上述分析知A为Cl2、B为SO2跟水反应的离子方程式Cl+SO+ 2HO = 4H+SOˉ+2Clˉ

【题目】用硫酸酸化的草酸(H2C2O4 , 二元弱酸)溶液能将KMnO4溶液中的MnO4﹣转化为Mn2+ . 某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表.
实验 | 温度 | 初始pH | 0.1mol/L | 0.01mol/L | 蒸馏水 | 待测数据(反应混合液褪色 |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | 2 | 20 | 50 | 30 | t2 |
③ | 常温 | 2 | 40 | a | b | t3 |
表中a、b的值分别为:a=、b=
(2)该反应的离子方程式 .
(3)若t1<t2 , 则根据实验①和②得到的结论是
(4)请你设计实验④验证MnSO4对该反应起催化作用,完成表中内容.
实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
若反应混合液褪色时间小于实验①中的t1 , 则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
(5)某化学小组用滴定法测定KMnO4溶液物质的量浓度:取W g草酸晶体(H2C2O42H2O,其摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液
V mL.请回答下列问题:
①该测定方法中(填“需要”或“不需要”)加入指示剂;
②计算得KMnO4溶液的c(KMnO4)=mol/L.(请写出最后化简结果)
