МвДїДЪИЭ
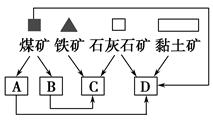
єПіЙ°±µДБчіМКѕТвНјИзПВЈє
»ШґрПВБРОКМвЈє
ЈЁ1Ј©№¤ТµєПіЙ°±µДФБПКЗµЄЖшєНЗвЖшЎЈµЄЖшКЗґУїХЖшЦР·ЦАліцАґµДЈ¬НЁіЈК№УГµДБЅЦЦ·ЦАл·Ѕ·ЁКЗ Ј¬ Ј»ЗвЖшµДАґФґКЗЛ®єНМјЗв»ЇєПОпЈ¬Рґіц·Ц±рІЙУГГєєНМмИ»ЖшОЄФБПЦЖИЎЗвЖшµД»ЇС§·ґУ¦·ЅіМКЅ Ј¬ Ј»
ЈЁ2Ј©Йи±ёAЦРє¬УРµзјУИИЖчЈ¬ґҐГЅєНИИЅ»»»ЖчЈ¬Йи±ёAµДГыіЖКЗ Ј¬ЖдЦР·ўЙъµД»ЇС§·ґУ¦·ЅіМКЅОЄ Ј»
ЈЁ3Ј©Йи±ёBµДГыіЖКЗ Ј¬ЖдЦРmєНnКЗБЅёцНЁЛ®їЪЈ¬ИлЛ®їЪКЗ ЈЁМоЎ°mЎ±»тЎ°nЎ±Ј©ЎЈІ»ТЛґУПа·ґ·ЅПтНЁЛ®µДФТтКЗ Ј»
ЈЁ4Ј©Йи±ёCµДЧчУГКЗ Ј»
ЈЁ5Ј©ФЪФБПЖшЦЖ±ё№эіМЦР»мУРµДCO¶ФґЯ»ЇјБУР¶ѕє¦ЧчУГЈ¬УыіэИҐФБПЖшЦРµДCOЈ¬їЙНЁ№эТФПВ·ґУ¦АґКµПЦЈє
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ТСЦЄ1000KК±ёГ·ґУ¦µДЖЅєвіЈКэK=0.627Ј¬ИфТЄК№COµДЧЄ»ЇВКі¬№э90%Ј¬ФтЖрКјОпЦРµДc(H2O):c(CO)І»µНУЪ ЎЈ
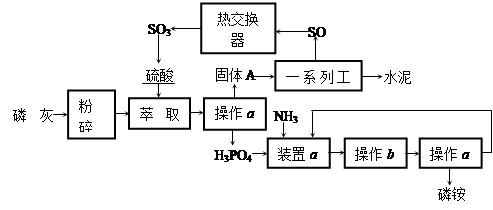
ЈєЈЁ1Ј©Тє»ЇЎў·ЦБуЈ»УлМј·ґУ¦єуіэИҐCO2Ј»C+H2O CO+H2Ј»CH4+H2O
CO+H2Ј»CH4+H2O CO+3H2Ј»ЈЁ2Ј©єПіЙЈЁ°±Ј©ЛюЈ»N2(g)+3H2(g)
CO+3H2Ј»ЈЁ2Ј©єПіЙЈЁ°±Ј©ЛюЈ»N2(g)+3H2(g) 2NH3(g)Ј»ЈЁ3Ј©АдИґЛюЈЁ»тАдДэЖчЈ©Ј»nЈ»ёЯОВЖшМеУЙАдИґЛюµДЙП¶ЛЅшИлЈ¬АдИґЛ®ґУПВ¶ЛЅшИлЈ¬ДжПтАдИґР§№ыєГЈ»ЈЁ4Ј©Ѕ«Тє°±УлОґ·ґУ¦µДФБПЖш·ЦАлЈ»ЈЁ5Ј©13.8ЎЈ
2NH3(g)Ј»ЈЁ3Ј©АдИґЛюЈЁ»тАдДэЖчЈ©Ј»nЈ»ёЯОВЖшМеУЙАдИґЛюµДЙП¶ЛЅшИлЈ¬АдИґЛ®ґУПВ¶ЛЅшИлЈ¬ДжПтАдИґР§№ыєГЈ»ЈЁ4Ј©Ѕ«Тє°±УлОґ·ґУ¦µДФБПЖш·ЦАлЈ»ЈЁ5Ј©13.8ЎЈ
ЅвОц

 їЪЛгДЬКЦПµБРґр°ё
їЪЛгДЬКЦПµБРґр°ёµз¶ЖОЫДаЦРє¬УРCr(OH)3ЎўAl2O3ЎўZnOЎўCuOЎўNiOµИОпЦКЈ¬№¤ТµЙПНЁ№эЎ°ЦРОВ±єЙХЎЄДЖСх»Ї·ЁЎ±»ШКХNa2Cr2O7µИОпЦКЎЈ
ТСЦЄЈєЛ®ЅюєуИЬТєЦРґжФЪNa2CrO4ЎўNaAlO2[ТІїЙ±нКѕОЄNaAl(OH)4]ЎўNa2ZnO2µИОпЦКЎЈ
ЈЁ1Ј©Л®Ѕюєу»ШКХCuЎўNiК±µДІЩЧчКЗ ЎЈЛ®ЅюєуµДИЬТєіК РФЈЁЎ°ЛбЎ±ЎўЎ°јоЎ±ЎўЎ°ЦРЎ±Ј©
ЈЁ2Ј©НкіЙСх»Ї±єЙХ№эіМЦРЙъіЙNa2CrO4µД»ЇС§·ЅіМКЅ
Cr(OH)3 + Na2CO3 + O2 Na2CrO4 + CO2 + H2O
Na2CrO4 + CO2 + H2O
ЈЁ3Ј©ВЛФьIIµДЦчТЄіЙ·ЦУРZn(OH)2Ўў ЎЈ
ЈЁ4Ј©ТСЦЄЈєўЩіэИҐВЛФьIIєуЈ¬ИЬТєЦРґжФЪИзПВ·ґУ¦ЈєCrO42ЎЄ+ 2H+ Cr2O72ЎЄ+ H2OЈ»ўЪNa2Cr2O7ЎўNa2CrO4ФЪІ»Н¬ОВ¶ИПВµДИЬЅв¶ИИзПВ±н
Cr2O72ЎЄ+ H2OЈ»ўЪNa2Cr2O7ЎўNa2CrO4ФЪІ»Н¬ОВ¶ИПВµДИЬЅв¶ИИзПВ±н
| »ЇС§КЅ | 20Ўж | 60Ўж | 100Ўж |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
Ў°ПµБРІЩЧчЎ±ЦРОЄЈєјМРшјУИлH2SO4Ј¬ АдИґЅбѕ§Ј¬№эВЛЎЈјМРшјУИлH2SO4ДїµДКЗ__________________________________________________ЎЈ
ЈЁ5Ј©№¤ТµЙП»№їЙТФФЪЛ®Ѕю№эВЛєуµДИЬТєЈЁNa2CrO4Ј©јУИлККБїH2SO4Ј¬УГКЇД«Чцµзј«µзЅвЙъІъЅрКфёхЈ¬РґіцЙъіЙёхµДµзј«·ґУ¦·ЅіМКЅ ЎЈ
»ФНїуЦчТЄіЙ·ЦCu2SЈ¬ИнГМїуЦчТЄіЙ·ЦMnO2Ј¬ЛьГЗ¶јє¬УРЙЩБїSiO2ЎўFe2O3µИФУЦКЎЈ№¤ТµЙПЧЫєПАыУГХвБЅЦЦїуОпЦЖ±ёБтЛбГМєНјоКЅМјЛбНµДЦчТЄ№¤ТХБчіМИзПВЈє
ТСЦЄЈєўЩMnO2ДЬЅ«ЅрКфБт»ЇОпЦРµДБтСх»ЇОЄµҐЦКБтЈ»
ўЪ[Cu(NH3)4]SO4іЈОВОИ¶ЁЈ¬ФЪИИЛ®ЦР»б·ЦЅвЙъіЙNH3Ј»
ўЫІї·ЦЅрКфСфАлЧУЙъіЙЗвСх»ЇОпіБµн µДpH·¶О§ИзПВ±нЛщКѕЈЁїЄКјіБµнµДpH°ґЅрКфАлЧУЕЁ¶ИОЄ1.0 molЎ¤L-1јЖЛгЈ©Јє
| | їЄКјіБµнµДpH | іБµнНкИ«µДpH |
| Fe3Ј« | 1.1 | 3.2 |
| Mn2Ј« | 8.3 | 9.8 |
| Cu2Ј« | 4.4 | 6.4 |
ЈЁ1Ј©ЛбЅюК±Ј¬ОЄБЛМбёЯЅюИЎВКїЙІЙИЎµДґлК©УР ЈЁИОРґТ»µгЈ©ЎЈ
ЈЁ2Ј©ЛбЅюК±Ј¬µГµЅµДЅюіцТєЦРЦчТЄє¬УРCuSO4ЎўMnSO4µИЎЈ
РґіцёГ·ґУ¦µД»ЇС§·ЅіМКЅ ЎЈ
ЈЁ3Ј©µчЅЪЅюіцТєpHµД·¶О§ОЄ Ј¬ЖдДїµДКЗ ЎЈ
ЈЁ4Ј©±ѕ№¤ТХЦРїЙС»·К№УГµДОпЦККЗ ЈЁРґ»ЇС§КЅЈ©ЎЈ
ЈЁ5Ј©ФЪёГ№¤ТХµДЎ°јУИИЗэ°±Ў±»·ЅЪЈ¬ИфјУИИµДОВ¶И№эµН»т№эёЯЈ¬¶јЅ«ФміЙ µДЅб№ыЎЈ
ЈЁ6Ј©УГ±кЧјBaCl2ИЬТєІв¶ЁСщЖ·ЦРMnSO4Ў¤H2OЦКБї·ЦКэК±Ј¬·ўПЦСщЖ·ґї¶ИґуУЪ100%ЈЁІв¶Ё№эіМЦРІъЙъµДОуІоїЙєцВФЈ©Ј¬ЖдїЙДЬФТтУР (ИОРґТ»ЦЦ)ЎЈ
2013Дк6ФВ20ИХЈ¬ЦР№ъіЙОЄКАЅзЙПµЪ¶юёціЙ№¦ЅшРРЎ°М«їХКЪїОЎ±µД№ъјТЎЈИзНјОЄМ«їХКЪїОЦРєЅМмФ±УГЧўЙдЖчПтЛ®ЗтДЪЧўИлїХЖшЈ¬ФЪЛ®ЗтДЪІъЙъБЛ БЅёц±кЧјµДЗтРОЖшЕЭЈ¬ЖшЕЭјИГ»УР±»ј·іцЛ®ЗтТІГ»УРИЪєПµЅТ»ЖрЈ¬Л®ЗтТІГ»УР±¬БСЎЈПВБРЛµ·ЁґнОуµДКЗ
| AЈ®КµСйКЗїЖС§·ўПЦµДЦШТЄКЦ¶ОЈ¬їЖС§·ўПЦНщНщРиТЄЅЁБўФЪКµСйКВКµµД»щґЎЦ®ЙП |
| BЈ®Л®µД·ЦЧУЧйіЙєНЅб№№Ј¬ФЪМ«їХЦРГ»УР·ўЙъёД±д |
| CЈ®ФЪМ«їХКµСйЦРЈ¬Из№ыНщЛ®ЗтЦР·Ц±рЧўИлЗвЖшЎў°±ЖшЈ¬Н¬СщТІДЬ№ЫІмµЅБЅёцЖшЕЭ |
| DЈ®Л®ЗтКµСйЦРЈ¬їЙУГОьЛ®ЦЅІ¶»сИчВдµДЛ®µО |
ФЪЅУґҐ·ЁІъЙъH2SO4µД№эіМЦР,¶ФЎ°·ПЖшЎў·ПЛ®Ўў·ПФьЎў·ПИИЎ±µДґ¦АнХэИ·µДКЗ(ЎЎЎЎ)
ўЩ·ПЖшУГ°±Л®ґ¦АнЎЎўЪОЫЛ®УГКЇ»ТИ鴦АнЎЎўЫ·ПФьУГАґФмЛ®Да»тБ¶МъЎЎўЬЙиЦГЎ°·ПИИЎ±№шВЇІъЙъХфЖшАґ№©ИИ»т·ўµз
| AЈ®Ц»УРўЩўЪ | BЈ®Ц»УРўЩўЫўЬ | CЈ®Ц»УРўЩўЪўЫ | DЈ®И«Ії |

 Ј¬ЖдЖЅєвіЈКэ±нґпКЅОЄK= ЎЈ
Ј¬ЖдЖЅєвіЈКэ±нґпКЅОЄK= ЎЈ