题目内容
(13分)醋酸亚铬水合物([Cr(CH3COO)2)]2·2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸。实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g)
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO-(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)检查虚框内装置气密性的方法是 。
(2)醋酸钠溶液应放在装置 中(填写装置编号,下同);盐酸应放在装置 中;
装置4的作用是 。
(3)本实验中所有配制溶液的水需煮沸,其原因是 。
(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是 阀门A、 阀门B (填“打开”或“关闭”)。
(5)本实验中锌粒须过量,其原因是 。
(6)为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是 。
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
(1)将装置连接好,关闭A、B阀门,往装置1中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好。反之,则气密性不好(2分,其它合理答案也给分);
(2)装置3,装置1(各1分);可以防止空气进入装置3(1分,其它合理答案也给分)。
(3)去除水中的溶解氧,防止Cr2+被氧化 (2分)
(4)打开;关闭 (各1分)
(5)产生足够的H2;与CrCl3充分反应得到CrCl2 (2分)
(6)C (2分)
解析试题分析:(1)可利用装置内外压强差来验证装置的气密性:将装置连接好,关闭A、B阀门,往装置1中加水,打开活塞后,水开始下滴,一段时间后,如果水不再下滴,表明装置气密性良好。反之,则气密性不好;(2)整套装置的工作原理是:先在装置2中制备出二价的铬离子,在制备过程中,因为二价铬离子容易被空气中的氧气氧化成三价。因此在装置2中,我们要放入足够多的锌粒,一是还原三价铬,二是用来产生氢气排除装置内的空气。反应开始前,应该先打开B让氢气充满整个装置,然后再关闭B,打开A,让装置2中的二价铬离子进入装置3,跟醋酸钠反应生成醋酸亚铬水合物。因此,醋酸钠溶液应放在装置3中,盐酸应放在装置1中;装置4的作用是:可以防止空气进入装置3。(3)本实验中所有配制溶液的水需煮沸,其原因是:去除水中的溶解氧,防止Cr2+被氧化(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是打开阀门A、关闭阀门B;这样装置2中的溶液就可以在氢气的压力下,将液体压往装置3中进行反应。(5)本实验中锌粒须过量,其原因是:①产生足够的H2;②与CrCl3充分反应得到CrCl2 。(6)洗涤[Cr(CH3COO)2)]2·2H2O产品,主要是洗去附着在表面的没有反应掉的二价铬离子、氯离子、醋酸根离子、钠离子等,不能用乙醇和盐酸,因为醋酸亚铬水合物,是微溶于醇,易溶于盐酸。因此先用水洗去杂质离子,再用乙醚来洗去多余的水。多余的乙醚可以挥发掉,选C 。
考点:考查物质的制备、分离和提纯。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下: 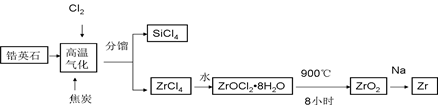
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2?8H2O在900℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选);
| A.二氧化锆纳米陶瓷是新型无机非金属材料 |
| B.1纳米=10-10米 |
| C.锆合金的硬度比纯锆要高 |
| D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起 |
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)某兴趣小组采用如图所示装置制取SO2
①下列实验方案适用如图所示装置制取所需SO2的试剂是_______(填序号)。
| A.Na2SO3溶液与稀硝酸 |
| B.Na2SO3固体与浓硫酸 |
| C.固体硫和氧气 |
| D.铜与浓硫酸 |
③尾气吸收装置的连接顺序是b接( )接 ( )接e。
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体(
 生产流程,其流程示意图如下:
生产流程,其流程示意图如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:

请回答:
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理________________________。
②浸出过程中主要反应的化学方程式是___________________________________________。
③氧化过程中加入MnO2粉的目的是______________________________________________;
反应的离子方程式是_________________________________________________________。
④用石灰浆调节pH,pH应调节的范围是___________________________________。
⑤滤渣的主要成分是____________________________________。
如图所示是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是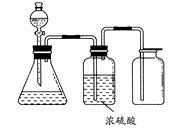
| A.铜屑和稀硝酸 |
| B.二氧化锰和浓盐酸 |
| C.用浓氨水和生石灰反应 |
| D.碳酸钙和稀盐酸 |


 =_____。
=_____。

