题目内容
【题目】含碳的化合物能形成上千万种化合物,并且有的物质之间很容易发生转化.请回答下列问题:
(1)有机物M在有光的时候很容易转化成N,其过程如图: 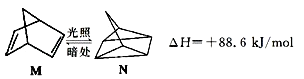
其中较稳定的物质是M,原因是 .
(2)已知 ![]() (l)的燃烧热为3267.5kJmol﹣1 ,
(l)的燃烧热为3267.5kJmol﹣1 , ![]() (l)+6O2(g)═6CO2(g)+3H2(g)
(l)+6O2(g)═6CO2(g)+3H2(g)
△H=a kJmol﹣1 , 则a﹣3267.5(填“>”、“<”或“=”).
(3)使Br2(g)和H2O(g)在1500℃时与焦炭反应,生成HBr和CO2 , 当有1mol Br2(g)参与反应时释放出125kJ热量,写出该反应的热化学方程式 .
(4)将C(石墨)、Al粉和TiO2固体在一定比例的条件下,在极高的温度下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1440kJmol﹣1 , 则反应过程中,每转移amol电子放出的热量为(用含a的表达式表示).
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJmol﹣1
CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280.0kJmol﹣1
O2(g)=CO2(g)△H=﹣280.0kJmol﹣1
C(石墨)+O2(g)=CO2(g)△H=﹣390.5kJmol﹣1
2Fe2O3(s)=4Fe(s)+3O2(g)△H= .
【答案】
(1)M转化为N为吸热反应,能量升高,M能量低,稳定些
(2)>
(3)2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)△H=﹣250kJ?mol﹣1
(4)120akJ
(5)+1643.0kJ?mol﹣1
【解析】解:(1) 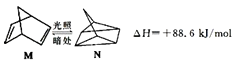 ,反应为吸热反应,M能量低于N,则M能量低稳定,
,反应为吸热反应,M能量低于N,则M能量低稳定,
所以答案是:M转化为N为吸热反应,能量升高,M能量低,稳定些;(2)已知 ![]() (l)的燃烧热为3267.5kJmol﹣1 ,
(l)的燃烧热为3267.5kJmol﹣1 , ![]() (l)+
(l)+ ![]() O2(g)═6CO2(g)+3H2O(l)△H=﹣3267.5kJmol﹣1 ,
O2(g)═6CO2(g)+3H2O(l)△H=﹣3267.5kJmol﹣1 , ![]() (l)+6O2(g)═6CO2(g)+3H2(g)△H=a kJmol﹣1 , 氢气燃烧放热,放热反应的焓变为负值,则a>﹣3267.5kJmol﹣1 , 所以答案是:>;(3)1molBr2参与反应时释放出125kJ热量,则反应2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)会放出250KJ的能量,即2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)△H=﹣250kJmol﹣1 , 所以答案是:2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)△H=﹣250kJmol﹣1;(4)将C(石墨)、Al粉和TiO2固体在一定比例的条件下,在极高的温度下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1440kJmol﹣1 , 所给反应中转移12个电子,故每转移1mol电子放出的热量为
(l)+6O2(g)═6CO2(g)+3H2(g)△H=a kJmol﹣1 , 氢气燃烧放热,放热反应的焓变为负值,则a>﹣3267.5kJmol﹣1 , 所以答案是:>;(3)1molBr2参与反应时释放出125kJ热量,则反应2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)会放出250KJ的能量,即2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)△H=﹣250kJmol﹣1 , 所以答案是:2Br2(g)+2H2O(g)+C(s)=4HBr(g)+CO2(g)△H=﹣250kJmol﹣1;(4)将C(石墨)、Al粉和TiO2固体在一定比例的条件下,在极高的温度下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=﹣1440kJmol﹣1 , 所给反应中转移12个电子,故每转移1mol电子放出的热量为 ![]() =120kJ,则反应过程中,每转移amol电子放出的热量为120a kJ,所以答案是:120a kJ;(5)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJmol﹣1②CO(g)+
=120kJ,则反应过程中,每转移amol电子放出的热量为120a kJ,所以答案是:120a kJ;(5)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+490.0kJmol﹣1②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280.0kJmol﹣1③C(石墨)+O2(g)=CO2(g)△H=﹣390.5kJmol﹣1依据盖斯定律计算,(①+②×3﹣③×3)×2得到:2Fe2O3(s)=4Fe(s)+3O2(g)△H=+1643.0 kJmol﹣1 , 所以答案是:+1643.0 kJmol﹣1 .
O2(g)=CO2(g)△H=﹣280.0kJmol﹣1③C(石墨)+O2(g)=CO2(g)△H=﹣390.5kJmol﹣1依据盖斯定律计算,(①+②×3﹣③×3)×2得到:2Fe2O3(s)=4Fe(s)+3O2(g)△H=+1643.0 kJmol﹣1 , 所以答案是:+1643.0 kJmol﹣1 .
【考点精析】本题主要考查了反应热和焓变的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热才能正确解答此题.

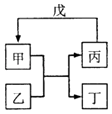
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲 | 乙 | 丙 | 戊 | |
① | SiO2 | NaOH | Na2SiO3 | CO2 |
② | Fe | H2O | Fe2O3 | H2 |
③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
④ | Na2O2 | CO2 | O2 | Na |
A.①③
B.①②
C.②④
D.①④