题目内容
(2009?徐州二模)下列排列顺序正确的是( )
分析:A、碳酸钠稳定不分解,碳酸钙高温分解,碳酸氢钠加热分解;
B、Fe(OH)3胶粒是很多Fe(OH)3集合体,大于溶液中离子;电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多,离子半径越大,据此判断;
C、醋酸属于酸,溶于水呈酸性,水为弱电解质,可以电离出氢离子,乙醇是非电解质,不能电离出氢离子;
D、水分子键存在氢键,高于同族其它元素氢化物,沸点最高,H2Se、H2S结构相似,相对分子质量越大,沸点越高.
B、Fe(OH)3胶粒是很多Fe(OH)3集合体,大于溶液中离子;电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多,离子半径越大,据此判断;
C、醋酸属于酸,溶于水呈酸性,水为弱电解质,可以电离出氢离子,乙醇是非电解质,不能电离出氢离子;
D、水分子键存在氢键,高于同族其它元素氢化物,沸点最高,H2Se、H2S结构相似,相对分子质量越大,沸点越高.
解答:解:A、碳酸钠稳定不分解,碳酸钙高温分解,碳酸氢钠加热分解,固体热稳定性:Na2CO3>CaCO3>NaHCO3,故A正确;
B、Fe(OH)3胶粒是很多Fe(OH)3集合体,大于溶液离子;电子层排布相同,核电荷数越大离子半径越小,所以C1->K+,最外层电子数相同,电子层越多,离子半径越大,所以K+>Na+,微粒半径:Fe(OH)3胶粒>C1->K+>Na+,故B错误;
C、醋酸属于酸,溶于水呈酸性,水为弱电解质,可以电离出氢离子,呈中性;乙醇是非电解质,不能电离出氢离子,给出质子的能力:CH3COOH>H2O>C2H5OH,故C错误;
D、水分子键存在氢键,高于同族其它元素氢化物,沸点最高,H2Se、H2S结构相似,相对分子质量越大,分子间作用力越强,沸点越高,故氢化物的沸点:H2O>H2Se>H2S,故D错误.
故选A.
B、Fe(OH)3胶粒是很多Fe(OH)3集合体,大于溶液离子;电子层排布相同,核电荷数越大离子半径越小,所以C1->K+,最外层电子数相同,电子层越多,离子半径越大,所以K+>Na+,微粒半径:Fe(OH)3胶粒>C1->K+>Na+,故B错误;
C、醋酸属于酸,溶于水呈酸性,水为弱电解质,可以电离出氢离子,呈中性;乙醇是非电解质,不能电离出氢离子,给出质子的能力:CH3COOH>H2O>C2H5OH,故C错误;
D、水分子键存在氢键,高于同族其它元素氢化物,沸点最高,H2Se、H2S结构相似,相对分子质量越大,分子间作用力越强,沸点越高,故氢化物的沸点:H2O>H2Se>H2S,故D错误.
故选A.
点评:本题综合性较大,涉及碳酸盐稳定性比较、微粒大小比较、氢化物沸点比较、电解质电离等,难度中等,旨在考查学生对规律的掌握,D中注意中学中常见存在氢键的物质.

练习册系列答案
相关题目
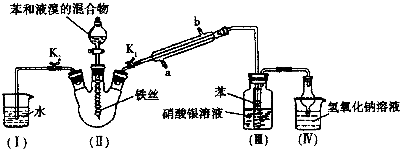
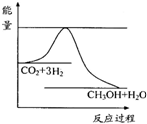 (2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.