题目内容
(2009?徐州二模)下列溶液中各微粒的浓度关系正确的是( )
分析:A.从影响盐类水解的因素的角度分析;
B.从电荷守恒的角度分析;
C.从质子守恒的角度分析;
D.0.2 mo1?L-1 HCl与0.1 mo1?L-1 NaAlO2溶液等体积混合,反应后溶液中存在Al3+和H+,溶液呈酸性.
B.从电荷守恒的角度分析;
C.从质子守恒的角度分析;
D.0.2 mo1?L-1 HCl与0.1 mo1?L-1 NaAlO2溶液等体积混合,反应后溶液中存在Al3+和H+,溶液呈酸性.
解答:解:A.碳酸铵中,碳酸根对铵根离子的水解起到促进作用,硫酸根离子不影响铵根离子的水解,硫酸亚铁铵中,亚铁离子对铵根离子的水解起到抑制作用,所以三种溶液中,铵根离子的浓度大小顺序是:③>②>①,故A错误;
B.pH相等的NaF与CH3COOK溶液中分别存在c(Na+)+c(H+)=c(F-)+c(OH-)、c(K+)+c(H+)=c(CH3COO-)+c(OH-),两种溶液pH相等,则有c(Na+)-c(F-)=c(K+)-c(CH3COO-)=c(OH-)-c(H+),故B错误;
C.Na2CO3溶液中存在质子守恒,即:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C正确;
D.0.2 mo1?L-1 HCl与0.1 mo1?L-1 NaAlO2溶液等体积混合,反应后溶液中存在Al3+和H+,溶液呈酸性,应存在c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),故D正确.
故选CD.
B.pH相等的NaF与CH3COOK溶液中分别存在c(Na+)+c(H+)=c(F-)+c(OH-)、c(K+)+c(H+)=c(CH3COO-)+c(OH-),两种溶液pH相等,则有c(Na+)-c(F-)=c(K+)-c(CH3COO-)=c(OH-)-c(H+),故B错误;
C.Na2CO3溶液中存在质子守恒,即:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C正确;
D.0.2 mo1?L-1 HCl与0.1 mo1?L-1 NaAlO2溶液等体积混合,反应后溶液中存在Al3+和H+,溶液呈酸性,应存在c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),故D正确.
故选CD.
点评:本题考查离子浓度大小比较,题目难度中等,注意把握影响盐类水解的因素,结合电荷守恒、质子守恒、物料守恒解答该题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
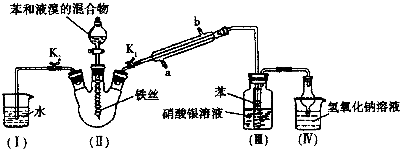
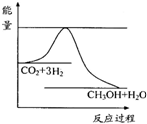 (2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.