题目内容
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表的________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
NaCl+H2O NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下图:
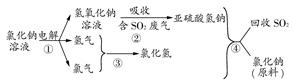
请写出②④的化学反应方程式:________、________。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表的________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
NaCl+H2O
 NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下图:

请写出②④的化学反应方程式:________、________。
(1)ⅠA
(2)物理变化
(3) 585
585
(4)NaOH+SO2=NaHSO3 NaHSO3+HCl=NaCl+H2O+SO2↑
(2)物理变化
(3)
 585
585(4)NaOH+SO2=NaHSO3 NaHSO3+HCl=NaCl+H2O+SO2↑
(1)氯化钠中的金属元素为钠,它应位于元素周期表的ⅠA族。
(2)将海水蒸馏变成水蒸气属于物理变化。
(3)NaCl的电子式为 ,要制36.5%的浓盐酸1000 t所消耗的食盐应为
,要制36.5%的浓盐酸1000 t所消耗的食盐应为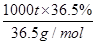 ×58.5 g/mol=585 t。
×58.5 g/mol=585 t。
(4)由图示给出的反应物和生成物不难写出②的反应方程式为NaOH+SO2=NaHSO3,④的反应方程式为NaHSO3+HCl=NaCl+H2O+SO2↑。
(2)将海水蒸馏变成水蒸气属于物理变化。
(3)NaCl的电子式为
 ,要制36.5%的浓盐酸1000 t所消耗的食盐应为
,要制36.5%的浓盐酸1000 t所消耗的食盐应为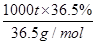 ×58.5 g/mol=585 t。
×58.5 g/mol=585 t。(4)由图示给出的反应物和生成物不难写出②的反应方程式为NaOH+SO2=NaHSO3,④的反应方程式为NaHSO3+HCl=NaCl+H2O+SO2↑。

练习册系列答案
相关题目

 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。