题目内容
【化学与技术】
工业上制取硝酸铵的流程图如下,请回答下列问题:
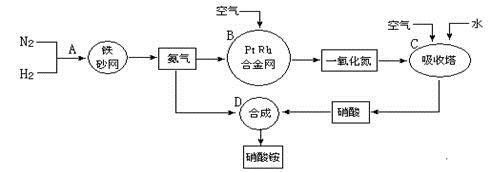
(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

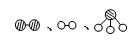 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2催化剂△ 7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
工业上制取硝酸铵的流程图如下,请回答下列问题:

(1)在上述工业制硝酸的生产中,B设备的名称是 ,其中发生反应的化学方程式为 。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是 。1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

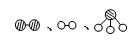 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是 、 。(3)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;在合成硝酸的吸收塔中通入空气的目的是 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:8NH3+6NO2催化剂△ 7N2+12H2O(NO也有类似的反应)
以上两种方法中,符合绿色化学的是 。
(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(6)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,应注意的事项及理由是:
| | 注意事项 | 理由 |
| ① | | |
| ② | | |
(1)氧化炉,4NH3+5O2 4NO+6H2O
4NO+6H2O
(2)铁砂网(或铁)。N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂
(3)利用余热,节约能源;使NO循环利用,全部转化成HNO3
(4)NH3还原法
(5)53
(6)①不能与碱性肥料混施;硝酸铵溶液呈酸性;
②不能剧烈撞击;硝酸铵易爆炸;
③不能在雨水较多的地区使用 硝酸铵吸收性强,易流失。
 4NO+6H2O
4NO+6H2O(2)铁砂网(或铁)。N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂
(3)利用余热,节约能源;使NO循环利用,全部转化成HNO3
(4)NH3还原法
(5)53
(6)①不能与碱性肥料混施;硝酸铵溶液呈酸性;
②不能剧烈撞击;硝酸铵易爆炸;
③不能在雨水较多的地区使用 硝酸铵吸收性强,易流失。
(1)工业制硝酸用氨氧化法制硝酸,其方法以氨和空气为原料,用Pt-Rh合金网为催化剂在氧化炉中进行,加热条件下生成NO和水,NO在冷却与O2反应生成NO2,NO2在吸收塔内用水吸收过量空气中O2的作用下转化为硝酸。最高浓度可达50%。制浓硝酸就是把50%HNO3与Mg(NO3)2或浓H2SO4蒸馏而得。方程式为4NH3+5O2 4NO+6H2O。
4NO+6H2O。
(2)N2和H2合成NH3所用催化剂是铁,由图知②所示N2和H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是利用余热,节约能源;在合成硝酸的吸收塔中不断通入空气,目的是提供充足的氧气,以便使NO循环利用,全部转化成硝酸;
(4)根据“绿色化学”要求,从根本上减少或杜绝污染,尽可能使原料和利用率提高来看,符合绿色的要求。
(5)由NH3制NO的产率是96%、NO制HNO3的产率是92%。
根据氮原子守恒可知:NH3—NO—HNO3,则1mol NH3可得硝酸为
1mol×96%×92%=0.8832mol;由HNO3—NH3—NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,硝酸所用去的NH3的质量占总消耗NH3的质量分数为1mol/(1mol+0.8832mol)×100%=53.1%.
(6)根据硝酸铵的性质来解答,由于硝酸铵受到撞击时易爆炸。因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;硝酸铵溶液呈酸性,所以不能与碱性肥料混施。
 4NO+6H2O。
4NO+6H2O。(2)N2和H2合成NH3所用催化剂是铁,由图知②所示N2和H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是利用余热,节约能源;在合成硝酸的吸收塔中不断通入空气,目的是提供充足的氧气,以便使NO循环利用,全部转化成硝酸;
(4)根据“绿色化学”要求,从根本上减少或杜绝污染,尽可能使原料和利用率提高来看,符合绿色的要求。
(5)由NH3制NO的产率是96%、NO制HNO3的产率是92%。
根据氮原子守恒可知:NH3—NO—HNO3,则1mol NH3可得硝酸为
1mol×96%×92%=0.8832mol;由HNO3—NH3—NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,硝酸所用去的NH3的质量占总消耗NH3的质量分数为1mol/(1mol+0.8832mol)×100%=53.1%.
(6)根据硝酸铵的性质来解答,由于硝酸铵受到撞击时易爆炸。因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;硝酸铵溶液呈酸性,所以不能与碱性肥料混施。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
 2NH3(g)(正反应为放热反应),下列说法中正确的是( )。
2NH3(g)(正反应为放热反应),下列说法中正确的是( )。 下列分析中正确的是
下列分析中正确的是