题目内容
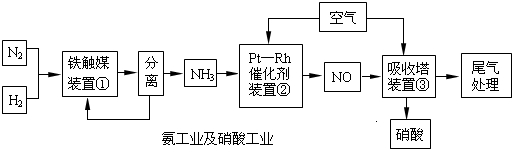
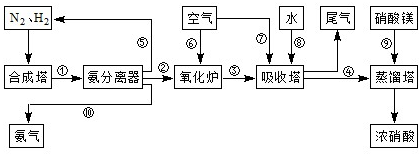
工业合成氨与制备硝酸一般可连续生产,流程如下:

(1)某温度下体积为200L的氨合成塔中,测得如下数据:
| 0 | 1 | 2 | 3 | 4 |
N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
NH3 | 0 | 0.200 | 0.600 | C3 | C3 |
根据表中数据计算0~2小时内N2的平均反应速率 mol?L-1?h-1
若起始时与平衡时的压强之比为a,则N2的转化率为 (用含a的代数式表示)
(2)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式
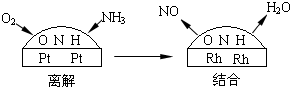
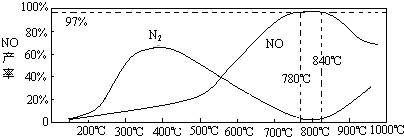
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如右图):
 4NH3+5O2
4NH3+5O2![]() 4NO+6H2O K1=1×1053(900℃)
4NO+6H2O K1=1×1053(900℃)
4NH3+3O2![]() 2N2+6H2O K2=1×1067(900℃)
2N2+6H2O K2=1×1067(900℃)
![]() 温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。吸收塔中需要补充空气的原因 。
温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因 。吸收塔中需要补充空气的原因 。
![]() (4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NOx的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO2 和N2请写出有关反应化学方程式 , 。
(4)尾气处理时小型化工厂常用尿素作为氮氧化物的吸收剂,此法运行费用低,吸收效果好,不产生二次污染,吸收后尾气中NOx的去除率高达99.95%。其主要的反应为氮氧化物混合气与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO2 和N2请写出有关反应化学方程式 , 。
(1)0.15(2分) 2(1-1/a) (3分)
(2)N2+6e-+6H+=2NH3 (2分)
(3)N2 (1分) 生成NO的反应为放热反应,升高温度转化率下降 (2分) 进一步与NO反应生成硝酸(1分)
(4) NO+NO2+H2O=2HNO2;(1分) CO (NH2)2+2HNO2=CO2+2N2+3H2O(1分)

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案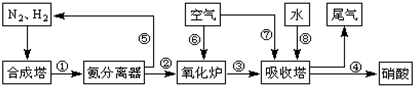
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)?CO2(g)+H2(g).t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.则该温度下此反应的平衡常数K=
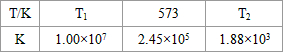
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
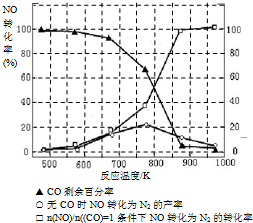
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如下图.据图分析,若不使用CO,温度超过775℃,发现NO的转化率降低,其可能的原因为
| n(NO) |
| n(CO) |

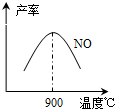 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因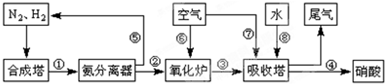
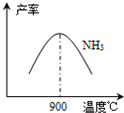 (3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率如图所示.温度高于900℃时,NH3产率下降的原因