题目内容
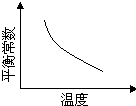
440℃时2SO2(g) + O2(g) 2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g) △H=-198kJ/mol,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),经5min达到平衡。其起始物质的量及SO2的平衡转化率如下表所示。
| | 甲 | 乙 | 丙 | |
| 起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
A.甲中SO2的速率为0.032mol·L-1·min-1 B.440℃时,平衡常数K=400
C.温度高于440℃时,平衡常数K>400 D.平衡时,SO2的转化率:α1<80%<α2
C
解析试题分析:A、平衡时消耗SO2的物质的量是0.4mol×0.8=0.32mol,浓度是0.32mol÷2L=0.16mol/L,因此甲中SO2的速率为0.16mol/L÷5min=0.032mol·L-1·min-1,A不正确;B、平衡时SO2的浓度是0.08mol/L÷2L=0.04mol/L,三氧化硫的浓度是0.16mol/L,氧气的浓度是(0.24mol-0.16mol)÷2L=0.04mol/L,所以该温度下反应的平衡常数K= =400,B正确;C、正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,C不正确;D、乙容器相当于是在甲容器的基础上增大二氧化硫的浓度,二氧化硫的转化率降低;丙容器相当于是在甲容器的基础上增大压强,平衡向正反应方向移动,二氧化硫的转化率增大,D正确,答案选C。
=400,B正确;C、正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,C不正确;D、乙容器相当于是在甲容器的基础上增大二氧化硫的浓度,二氧化硫的转化率降低;丙容器相当于是在甲容器的基础上增大压强,平衡向正反应方向移动,二氧化硫的转化率增大,D正确,答案选C。
考点:考查可逆反应的有关计算以及外界条件对平衡状态的影响

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 在密闭容器中发生反应: aX(g)+bY(g)  cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是( )
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是( )
| A.平衡向正反应方向移动 | B.(a+b)>(c+d) |
| C.Z的体积分数变大 | D.X的转化率变小 |
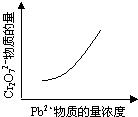
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
已知:3CH4(g) + 2N2(g) 3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示:
3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示: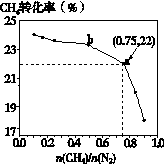
下列说法正确的是
| A.n(CH4)/n(N2)越大,CH4的转化率越高 |
| B.n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大 |
| C.b点对应的平衡常数比a点的大 |
| D.a点对应的NH3的体积分数约为26% |
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
| A.降低温度 | B.恒容充入氮气 | C.恒压充入氦气 | D.恒容充入氦气 |
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol·L—1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
| A.实验进程中可用pH试纸测定溶液的pH |
B.c点所示溶液中: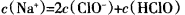 |
| C.向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 |
D.由a点到b点的过程中,溶液中 减小 减小 |
可逆反应A(?)+a B(g)? ?C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
?C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是 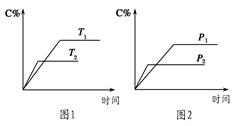
| A.当压强由p1变为 p2时,逆反应速率将变大 |
| B.该反应的正反应为放热反应 |
| C.若a=2,则A为液态或固体 |
| D.恒温恒容条件下,增加B的物质的量,B的转化率和该反应的化学平衡常数都将增大 |
下列说法正确的是
A.已知2SO2(g)+ O2(g) 2SO3 (g)△H<0,该反应在任何温度下均可自发进行 2SO3 (g)△H<0,该反应在任何温度下均可自发进行 |
| B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) ="l.0" × l0-a,该溶液的pH=7+0.5a |
| D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1AgNO3溶液,先生成Ag2CrO4沉淀 |
 2PbCrO4(s)+2H+(aq)△H<0
2PbCrO4(s)+2H+(aq)△H<0