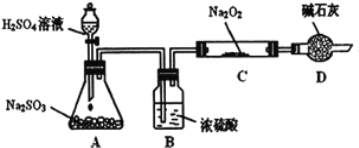
��Ŀ����
����Ŀ�����������䡱�������������ص㹤�̣������������ָ��Ȼ��������Ҫ�ɷ��Ǽ��飮��ҵ�Ͻ�̼��ˮ�ڸ����·�Ӧ�Ƶ�ˮú����ˮú������Ҫ�ɷ���CO��H2 �� ���ߵ������ԼΪ1��1����֪1mol CO������ȫȼ������CO2����ų�283kJ������1molH2��ȫȼ������Һ̬ˮ�ų�286kJ������1molCH4 ������ȫȼ������CO2�����Һ̬ˮ�ų�890kJ������
��1��д��H2��ȫȼ������Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ�� �� ��1molCH4������ȫȼ������CO2�����ˮ�������ų������� 890kJ�����������=��������
��2������ˮú���������ɷ֣���ͬ״�������õ���ȵ�����������ˮú�������������ԼΪ��ȼ�����ɵ�CO2 ��������ԼΪ ��
��3���������ݺͼ���˵��������Ȼ������ˮú��������ȼ�ϣ�ͻ�����ŵ��� ��
���𰸡�
��1��2H2��g��+O2��g��=2H2O��l����H=��572kJ?mol��1����
��2��3.1��1��1.55��1
��3����ֵ�ߣ���ȾС
���������⣺��1��1mol H2��ȫȼ������Һ̬ˮ�ų�286kJ����������H2��ȫȼ��������̬ˮ���Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��l����H=��572kJmol��1��1mol CH4������ȫȼ������CO2�����Һ̬ˮ�ų�890kJ������Һ̬ˮ��Ϊ��̬ˮ���ȣ�������ͬ�����£�1mol CH4������ȫȼ������CO2�����ˮ�������ų�������С��890kJ��
���Դ��ǣ�2H2��g��+O2��g��=2H2O��l����H=��572kJmol��1��������2�������Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��l����H=��572kJmol��1��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��890kJ/mol��2CO��g��+O2��g��=2CO2��g����H=��566KJ/mol��ˮú������Ҫ�ɷ���CO��H2 �� ���ߵ������Ϊ1��1��1molCH4ȼ�շ���890kJ��1molCO��H2���������� ![]() kJ=284.5kJ����ͬ״�������õ���ȵ�����������ˮú�������������ԼΪ
kJ=284.5kJ����ͬ״�������õ���ȵ�����������ˮú�������������ԼΪ ![]() ��
�� ![]() =3.1��1��ȼ�����ɵ�CO2��������ԼΪ
=3.1��1��ȼ�����ɵ�CO2��������ԼΪ ![]() =1.55��1��
=1.55��1��
���Դ��ǣ�3.1��1��1.55��1����3���������ݺͼ���˵������ͬ���ʵ�������Ȼ����ˮú������Ȼ��ȼ�շų��������࣬����ֵ�ߣ�ȼ�ղ�������������CO2�٣����Դ��ǣ���ֵ�ߣ���ȾС��

 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д� ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д� ������ҵ��ٳɳ����½������������ϵ�д�
������ҵ��ٳɳ����½������������ϵ�д�����Ŀ����������ʵ��������������õ��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | �ⶨ�����ʵ���Ũ�ȵ�Na2CO3��Na2SO4��Һ��pH��ǰ�ߵ�PH�Ⱥ��ߵĴ� | Ԫ�طǽ�������S>C |
B | ��ʢ��Fe(NO3)2��Һ���Թ��м���0.lmol.L-1H2SO4��Һ���Թܿڳ��ֺ���ɫ���� | ��Һ��NO3-��Fe2+��ԭΪNO2 |
C | ��FeBr2��Һ�м���������ˮ���ټ�CCl4��ȡ��CCl4����ɫ | Fe2+�Ļ�ԭ��ǿ��Br- |
D | ����Һ�еμ������ữ��BaC12��Һ��������ɫ���� | ��Һ��һ������SO42- |
A. A B. B C. C D. D