题目内容
(14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴铜原子的基态电子排布式是 ▲ 。比较第一电离能Cu ▲ Zn(填 “>”、“=”、“<”),说明理由 ▲ 。
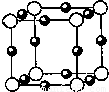
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为 ▲ 。(每个球均表示1个原子)
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为 ▲ 杂化,与NH3互为等电子体的粒子有 ▲ 。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲ 。
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。
(14分)
(1)① 1s22s22p63s23p63d104s1或[Ar] 3d104s1(2分) <(1分) Cu失去1个电子后内层电子达到全充满的稳定状态(1分)
(2) Cu3N(2分)
(3)① SP3 H3O+ (各1分)
②Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3=Cu(NH3)42++2OH-(2分)
(3)(2分)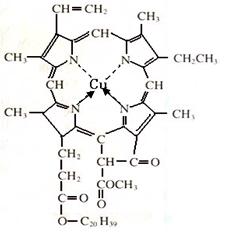
解析

练习册系列答案
相关题目
 铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途.
铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途.