题目内容
【题目】某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验:
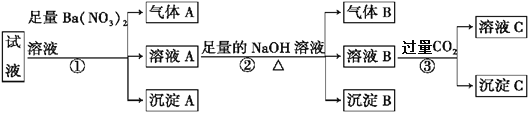
下列有关判断不正确的是
A. 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 原溶液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中反应的离子方程式为2AlO2-+CO2+3H2O2Al(OH)3↓+ CO32-
D. 气体A、B之间能发生反应
【答案】C
【解析】某强酸性溶液中CO32-不存在,Fe2+和NO3-不能同时存在,试液中加入过量硝酸钡溶液,生成气体证明一定含有Fe2+、则原溶液中一定不存在NO3-,气体为NO,沉淀A为BaSO4,原溶液中一定不存在Ba2+,一定存在SO42-,溶液A中加入过量氢氧化钠溶液生成气体B为NH3,确定原溶液中含有NH4+,沉淀B为Fe(OH)3,由于溶液B中含有Ba2+,OH-,溶液B加入过量二氧化碳发生反应③,生成的沉淀一定含有Al(OH)3,溶液B中一定含有AlO2-,则原溶液中一定含有Al3+;(过量Ba2+进入溶液B后,在过量的二氧化碳作用下转化为碳酸氢钡而没有生成BaCO3沉淀)。A、原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+,选项A正确;B、上述分析可知,原溶液中一定没有的离子为:Ba2+、CO32-、NO3-,选项B正确;C、步骤③中反应的离子方程式可能为OH-+CO2=HCO3-或AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,选项C不正确;D、气体A为NO,气体B为NH3,二者之间能发生氧化还原反应,选项D正确。答案选C。

练习册系列答案
相关题目

