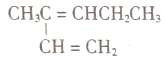题目内容
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_______。
(2)高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
① Na2FeO4中铁元素的化合价是______价。
② 用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是_______(用离子方程式表示)。
③ 工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 +10NaOH+3NaClO=2_____+5_____+9_______。
【答案】2CN-+4H2O+O2 ![]() 2HCO3-+2NH3+6Fe3++3H2O
2HCO3-+2NH3+6Fe3++3H2O ![]() Fe(OH)3+3H+Na2FeO4H2ONaCl
Fe(OH)3+3H+Na2FeO4H2ONaCl
【解析】
本题考查氧化还原反应。
(1)由题意可知,在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,反应的离子方程式为:2CN-+4H2O+O2![]() 2HCO3-+2NH3。(2)设Na2FeO4中铁元素的化合价为x,由化合价代数和为0可得:+1×2+x+(-2)×4=0,解得x=+6;Fe3+是弱碱阳离子,能水解生成Fe(OH)3胶体,Fe(OH)3胶体,可以吸附水中悬浮物并凝聚沉降达到净水的目的,Fe3+水解的离子方程式为:Fe3++3H2O
2HCO3-+2NH3。(2)设Na2FeO4中铁元素的化合价为x,由化合价代数和为0可得:+1×2+x+(-2)×4=0,解得x=+6;Fe3+是弱碱阳离子,能水解生成Fe(OH)3胶体,Fe(OH)3胶体,可以吸附水中悬浮物并凝聚沉降达到净水的目的,Fe3+水解的离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+;由于是用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,故2mol FeCl3失去6mol电子,被氧化为2molNa2FeO4,失去的6mol电子能被3molNaClO得到,NaClO中+1价氯元素还原为-1价,得3molCl-,加上2molFeCl3中的6molCl-,一共会生成9molNaCl,反应物中有10molNaOH,根据氢原子的守恒可知,产物中会生成5molH2O。
Fe(OH)3+3H+;由于是用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,故2mol FeCl3失去6mol电子,被氧化为2molNa2FeO4,失去的6mol电子能被3molNaClO得到,NaClO中+1价氯元素还原为-1价,得3molCl-,加上2molFeCl3中的6molCl-,一共会生成9molNaCl,反应物中有10molNaOH,根据氢原子的守恒可知,产物中会生成5molH2O。

【题目】向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,符合图像的一组是

X | Y | |
A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
D | NaAlO2、氨水、NaOH | H2SO4 |
【题目】针对下列9种元素,完成以下各小题
周期 | IA | ⅡA | ⅢA | ⅣA | ⅥA | ⅦA | O | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)常见单质为有色气体的元素是_______(填名称)。
(2)用电子式表示元素④和⑨形成化合物的过程_________。
(3)最高价氧化物对应的水化物中酸性最强的是_________(填化学式)。
(4)④和⑥两者的最高价氧化物对应的水化物反应的离子方程式为_______。
(5)⑦的单质的用途正确的是_____。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(6)元素①和⑦非金属性较强的是____(填写元素符号),写出一个能表示二者非金属性强弱关系的化学方程式为:_______ 。