题目内容
下列说法正确的是
A. HCl、HBr、HI的分子间作用力依次增大,热稳定性也依次增强
B. N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
C. 在O2、CO2和SiO2中,都存在共价键,它们均由分子构成
D. KOH和MgCl2都是离子晶体,均在共价键和离子键
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
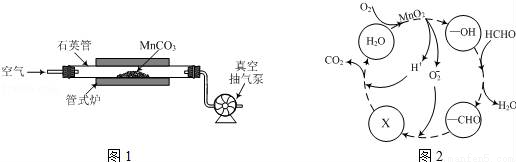
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠

已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
下列说法正确的是( )
A. 二氧化硫能使高锰酸钾酸性溶液迅速褪色
B. 用澄清石灰水鉴别二氧化硫和二氧化碳
C. 硫粉在过量的纯氧中燃烧可以生成三氧化硫
D. 少量二氧化硫通入浓的氯化钙溶液中能生成白色沉淀
四氯化钛(TiCl4)是制取航天工业材料——钛合金的重要原料。实验室以TiO2和CCl4为原料树取液态TiCl4的装置如图所示(部分夹持装置省略)。
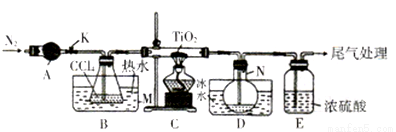
已知:有关物质的性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550 ℃时能被氧气氧化 |
请回答下列问题:
(1)仪器A的名称是________,仪器A中盛装的试剂是___________。
(2)CCl4的电子式为__________。
(3)装置C处硬质玻管中反应的化学方程式为__________________。
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为________________。
(5)仪器N中收集到的物质主要有___________(写化学式),从产物中分离出TiCl4的实验方法是_____________。
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2∶1的CO和CO2混合气体,该反应中氧化剂与还原剂的物质的量之比为________。请设计实验方案验证产物气体中有CO:_______________。


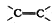 ⑥-C6H5 ⑦Br- ⑧-COOH ⑨-CH3其中不是官能团的是
⑥-C6H5 ⑦Br- ⑧-COOH ⑨-CH3其中不是官能团的是