题目内容
(1)某学习小组利用下图装置制取氯气并探究其性质。
①甲装置中反应的化学方程式是 ;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象) ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 。
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究。
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol·L-1盐酸、品红溶液、新制澄清石灰水。
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含 ;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3 。
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论 | |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管 | 若无气体放出且澄清石灰水未见浑浊,则假设一成立; |
| ② | | |
(14分)
(1)①MnO2+4HCl (浓)  MnCl2+ Cl2↑+2H2O (2分)
MnCl2+ Cl2↑+2H2O (2分)
②KSCN溶液(1分);溶液变红色(1分)[或NaOH溶液,红褐色沉淀等合理答案均给分];
③Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3(2分)
(2)CaCO3、CaCl2(2分)
(3)10-8/(a-0.1) (2分)实验步骤 预期现象和结论 ① 加入适量1mol/L-1盐酸(1分),塞上带导管的单孔塞,将导管另一端插入A试管中(1分) 若有气体放出且澄清石灰水未见浑浊,则假设二或三成立[或假设三不成立] (1分) ② 用胶头滴管向上述步骤后的B试管中滴入几滴品红溶液,震荡(1分)[或另取少量样品于试管中,滴入几滴蒸馏水震荡,再滴入品红溶液] 若品红不褪色,则假设二成立(1分);若品红褪色,假设三成立(1分)
解析试题分析:
(1)①实验室制取氯气的反应:MnO2+4HCl (浓)  MnCl2+ Cl2↑+2H2O。②FeCl2溶液与Cl2发生氧化还原反应生成三价铁离子,加入KSCN溶液,溶液变红色。③由题意得:Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3。
MnCl2+ Cl2↑+2H2O。②FeCl2溶液与Cl2发生氧化还原反应生成三价铁离子,加入KSCN溶液,溶液变红色。③由题意得:Cl2+2H2O+Na2CO3=" NaCl+" NaCl+2NaHCO3。
(2)漂白粉主要成分CaCl2、Ca(ClO)2,Ca(ClO)2变质会生成CaCO3。提出假设二:该漂白粉全部变质,含CaCO3、CaCl2。根据假设可知检测CaCO3的实验方案。
考点:考查元素及化合物性质、化学实验的设计、操作、化学计算等相关知识。、氧化还原反应计算,结合图像的化学计算。

以下进行性质比较的实验,不合理的是
| A.比较Cu、Fe2+的还原性:铁加入硫酸铜溶液中 |
| B.比较氯、溴单质的氧化性:溴化钠溶液中通入氯气 |
| C.比较镁、铝金属性:氯化镁、氯化铝溶液中分别加入过量的NaOH溶液 |
| D.比较碳、硫非金属性:测定同条件同物质的量浓度的Na2CO3、Na2SO4溶液的pH |
下述实验不能达到预期实验目的的是
| 序号 | 实验内容 | 实验目的 |
| A | 将2.5g CuSO4·5H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
(14分)
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | | 36.0 |
| ③ | | 0.2 | 2.0 | 90.0 |

(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
沈阳理工大学在废旧电池回收处理现状研究报告中报道了一种湿法处理方法,以下是对废旧电池材料(含有Ni(OH)2、碳粉、氧化铁和铝箔等)进行资源回收所设计的实验流程
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③金属离子在该实验流程下完全沉淀的pH:
| 离子 | Al3+ | Fe3+ | Ni2+ |
| pH | 5.2 | 4.1 | 9.7 |
(1)物质A 的作用是调节溶液的pH以除去杂质Fe3+和Al3+,以下最适合作为A物质的是________。
A.NiO B.盐酸 C.NaOH D.氨水
(2)滤渣②的主要成分是_________________________________。
(3)写出加入Na2C2O4溶液反应的化学方程式: _____________。
(4)写出电解滤液③的阴极反应式___________________________。
检验电解滤液③时阳极产生的气体的方法是用湿润的________试纸检验。
(5)由沉淀A生成Ni(OH)3的过程是先在滤渣③中加入过量NaOH溶液进行沉淀转化,待反应完全后再通入电解滤液③产生的气体进行氧化,请写出该氧化过程的离子方程式:__________________。
(6)如何检验Ni(OH)3是否洗涤干净?
________________________________。
[实验化学]
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是 。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、 和 。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1 K2Cr2O7标准溶液bmL,则滤液中
c(Fe2+)= mol·L—1
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是 (填序号)。
| A.加入适当过量的H2O2溶液 | B.缓慢滴加H2O2溶液并搅拌 |
| C.加热,使反应在较高温度下进行 | D.用氨水调节pH=7 |
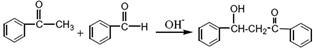
 (查尔酮)
(查尔酮)



