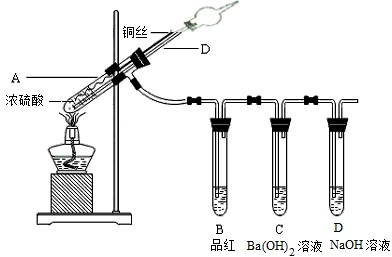
题目内容
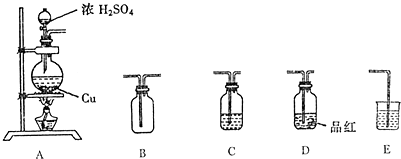
为了探究铜与浓硫酸的反应,某研究性学习小组做了如下实验:
①在放有铜片的圆底烧瓶中加入10 mL浓硫酸,加热煮沸10 min(如上图所示)后,所得固体分离除去未反应的铜片,再经水洗仍有大量黑色不溶物。
②取少量不溶物,向其中加入几滴浓硝酸,产生大量红棕色气体。
③取少量不溶物,向其中加5 mL酒精,充分振荡后,静置、过滤,把滤液移入盛有水的小试管中,振荡,出现浑浊。
④取少量不溶物,向其中加入3 mL氨水,振荡,溶液呈无色,在空气中静置,溶液变为深蓝色。
⑤取少量不溶物,向其中加入浓盐酸并加热,沉淀几乎全部溶解。
为了解释上述现象,学习小组通过查阅资料了解到:
| a.铜与浓硫酸反应的不溶性副产物可能有:CuS、Cu2S、Cu2O、S等物质; b.CuS和Cu2S都能溶于热的浓盐酸; c.Cu2O能溶于氨水生成无色的[Cu(NH3)2]+, [Cu(NH3)2]+在氨水中被空气中的氧气氧化成深蓝色的[Cu(NH3)4]2+。 |
回答下列问题:
(1)第②步操作要注意的问题是____________ ;对比①②两步操作中的现象,你能得到的结论是____________ 。
(2)第③步操作中出现的沉淀是____________ ,请解释出现这一现象的原因____________ 。
(3)写出④步涉及的离子方程式____________ 。
(4)综合分析铜与浓硫酸的反应,生成的不溶物是____________。
.解析:(1)大量红棕色污染性气体需要妥善处理。
(2)硫在酒精中微溶,在酒精与H2O的混合溶液中溶解度更小,所以把硫的酒精饱和溶液加入水中会出现浑浊。
(3)④说明不溶物中有Cu2O。
(4)综上分析,黑色不溶物的成分为:Cu2O、S和CuS、Cu2S中的一种或两种
答案:(1)必须在密闭系统中(或在通风橱中)进行,防止污染空气(或防止中毒)黑色沉淀中有还原性物质,浓硝酸的氧化性强于浓硫酸
(2)硫(或S)硫微溶于酒精但不溶于水,将硫的酒精溶液倒入水中,即可析出固体硫
(3)Cu2O+4NH3·H2O=2[Cu(NH3)2]++2OH-+3H2O,
4[Cu(NH3)2]++8NH3·H2O+O2=4[Cu(NH3)4]2++4OH-+6H2O
(4)Cu2O、S以及CuS和Cu2S中的一种或两种

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案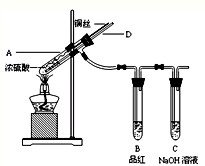 某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.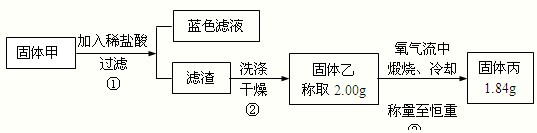
 (2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.
(2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.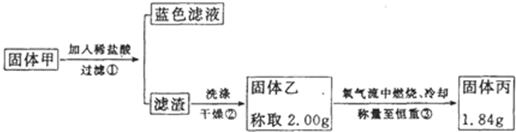
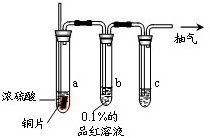 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(见图,图中夹持仪器和加热仪器没有画出).根据题意完成下列填空:
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(见图,图中夹持仪器和加热仪器没有画出).根据题意完成下列填空: