题目内容
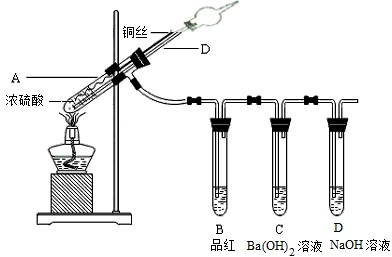
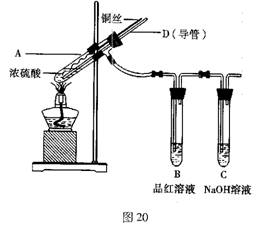
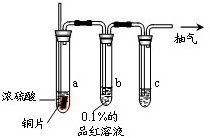 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(见图,图中夹持仪器和加热仪器没有画出).根据题意完成下列填空:
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(见图,图中夹持仪器和加热仪器没有画出).根据题意完成下列填空:(1)实验时,试管b中观察到的现象是
(2)试管c是尾气吸收装置,则其中的试剂是
(3)反应结束后在试管c的末端抽气,目的是
(4)实验中发现:在铜片表面有黑色固体生成,未见其他颜色.为了研究黑色固体的成分,他们进行了以下探究:
(1)甲同学猜想:黑色固体是未及溶解于酸的纯净的CuO.其猜想可用化学方程式表示为:
Cu+H2SO4(浓)
| △ |
(2)乙同学认为黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是
a.Cu2S、CuS都是黑色的
b.Cu与浓H2SO4在加热条件下反应还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu化合价上升与S化合价下降有多种可能.
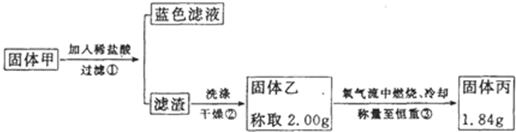
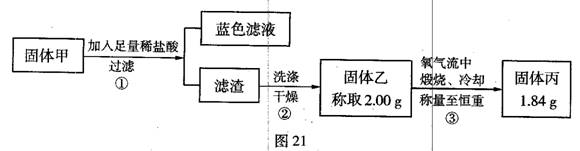
(5)丙同学认可乙的观点,并计划通过实验测定黑色固体的成分.查资料后得知CuO、Cu2S和CuS高温灼烧后的最终残留物均为红色的Cu2O.他收集了部分铜片上的黑色固体,经洗涤、
(6)丙同学确定黑色固体除CuO外肯定还含有
分析:(1)铜和浓硫酸加热反应生成二氧化硫具有漂白作用;
(2)二氧化硫是污染性气体,是酸性氧化物可以被氢氧化钠溶液吸收;
(3)末端抽气使污染性气体二氧化硫全部被氢氧化钠溶液吸收,a中长玻璃管是为了压强平衡便于抽气进行;
(4)(1)依据猜想黑色固体为氧化铜,则铜和浓硫酸反应生成氧化铜、二氧化硫和水,依据原子守恒电子守恒配平写出;
(2)黑色固体除CuO外还可能含有黑色的固体Cu2S和CuS,依据氧化还原反应元素化合价升降分析判断产物;
(5)固体从溶液中分离出来洗涤后需要干燥称重,称重需要到称到恒重后才会减少误差;
(6)依据实验过程中物质质量计算分析判断.
(2)二氧化硫是污染性气体,是酸性氧化物可以被氢氧化钠溶液吸收;
(3)末端抽气使污染性气体二氧化硫全部被氢氧化钠溶液吸收,a中长玻璃管是为了压强平衡便于抽气进行;
(4)(1)依据猜想黑色固体为氧化铜,则铜和浓硫酸反应生成氧化铜、二氧化硫和水,依据原子守恒电子守恒配平写出;
(2)黑色固体除CuO外还可能含有黑色的固体Cu2S和CuS,依据氧化还原反应元素化合价升降分析判断产物;
(5)固体从溶液中分离出来洗涤后需要干燥称重,称重需要到称到恒重后才会减少误差;
(6)依据实验过程中物质质量计算分析判断.
解答:解:(1)浓硫酸在加热条件下被铜还原为二氧化硫气体,二氧化硫具有漂白作用,能使品红溶液褪色,故答案为:品红溶液褪色;
(2)试管c是尾气吸收装置,二氧化硫是污染性气体,是酸性氧化物,需要用氢氧化钠溶液吸收,故答案为:NaOH溶液;
(3)装置中会有剩余的二氧化硫气体,不能排放到大气中,反应结束后在试管c的末端抽气是为了生成的二氧化硫全部被吸收,大试管a中长玻璃导管的作用是保持压强便于抽气进行,
故答案为:使生成的二氧化硫完全被吸收;使得抽气容易进行;
(4)(1)甲同学猜想:黑色固体是未及溶解于酸的纯净的CuO.化学方程式表示为Cu+H2SO4
CuO+SO2↑+H2O,故答案为:CuO+SO2↑+H2O;
(2)乙同学认为黑色固体除CuO外还可能含有Cu2S和CuS,
a.Cu2S、CuS都是黑色的可能含有,故a符合;
b.Cu与浓H2SO4在加热条件下,铜做还原剂,浓硫酸做氧化剂,氧元素在硫酸中,所以反应不可能放出O2,故b不符合;
c.浓硫酸是氧化剂,铜是还原剂,Cu化合价上升到+1价或+2价与S化合价下降从+6价变化为+4价,-2价等有多种可能.故c符合;
故答案为:a、c;
(5)固体净化是洗涤后、干燥、称重;操作需要称量至恒重,减少误差,故答案为:干燥;恒重操作;
(6)假设0.483g都是CuO,经高温灼烧后得到Cu2O 质量是0.4347.而现在只有0.420g,所以得出一定含有高温灼烧后质量小于0.420g的物质.假设0.483g都是Cu2S,高温灼烧后,得到Cu2O质量0.4347g,
假设0.483g都是CuS,高温灼烧后,得到Cu2O质量0.36225g,
故答案为:CuS.
(2)试管c是尾气吸收装置,二氧化硫是污染性气体,是酸性氧化物,需要用氢氧化钠溶液吸收,故答案为:NaOH溶液;
(3)装置中会有剩余的二氧化硫气体,不能排放到大气中,反应结束后在试管c的末端抽气是为了生成的二氧化硫全部被吸收,大试管a中长玻璃导管的作用是保持压强便于抽气进行,
故答案为:使生成的二氧化硫完全被吸收;使得抽气容易进行;
(4)(1)甲同学猜想:黑色固体是未及溶解于酸的纯净的CuO.化学方程式表示为Cu+H2SO4
| ||
(2)乙同学认为黑色固体除CuO外还可能含有Cu2S和CuS,
a.Cu2S、CuS都是黑色的可能含有,故a符合;
b.Cu与浓H2SO4在加热条件下,铜做还原剂,浓硫酸做氧化剂,氧元素在硫酸中,所以反应不可能放出O2,故b不符合;
c.浓硫酸是氧化剂,铜是还原剂,Cu化合价上升到+1价或+2价与S化合价下降从+6价变化为+4价,-2价等有多种可能.故c符合;
故答案为:a、c;
(5)固体净化是洗涤后、干燥、称重;操作需要称量至恒重,减少误差,故答案为:干燥;恒重操作;
(6)假设0.483g都是CuO,经高温灼烧后得到Cu2O 质量是0.4347.而现在只有0.420g,所以得出一定含有高温灼烧后质量小于0.420g的物质.假设0.483g都是Cu2S,高温灼烧后,得到Cu2O质量0.4347g,
假设0.483g都是CuS,高温灼烧后,得到Cu2O质量0.36225g,
故答案为:CuS.
点评:本题考查了浓硫酸性质的应用,产物性质的探究,二氧化硫的性质分析应用,分析推断和实验验证设计,题目较难.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
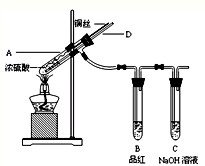 某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.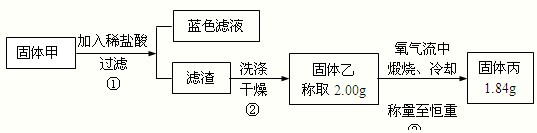
 (2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.
(2012?长沙模拟)某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.