题目内容
A、B、C三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-和C-,离子半径A2->C-;B2+ 与C-离子具有相同电子结构,下列说法不正确的是( )
| A.原子序数为A>B>C |
| B.离子半径为A2->C->B2+ |
| C.原子半径B>A>C |
| D.原子最外层电子数C>B>A |
由A、C的最低价离子分别为A2-和C-,则A为ⅥA族元素,C为ⅦA族元素,B2+和C-具有相同的电子层结构,则B在C的下一周期,则B为Mg元素,C为F元素,A、B同周期,则A为S元素,
A、A为S元素,B为Mg元素,C为F元素,原子序数A>B>C,故A正确;
B、离子的电子层数越多,半径越大,具有相同核外电子结构的离子,核电荷数越大,半径越小,所以A2->C->B2+,
故B正确;
C、A为S元素,B为Mg元素,C为F元素,同周期原子半径从左到右逐渐减小,电子层数越多,半径越大,则有B>A>C,故C正确;
D、A为S元素,B为Mg元素,C为F元素,最外层电子数分别为6、7、2,原子最外层电子数B>A>C,故D错误.
故选:D.
A、A为S元素,B为Mg元素,C为F元素,原子序数A>B>C,故A正确;
B、离子的电子层数越多,半径越大,具有相同核外电子结构的离子,核电荷数越大,半径越小,所以A2->C->B2+,
故B正确;
C、A为S元素,B为Mg元素,C为F元素,同周期原子半径从左到右逐渐减小,电子层数越多,半径越大,则有B>A>C,故C正确;
D、A为S元素,B为Mg元素,C为F元素,最外层电子数分别为6、7、2,原子最外层电子数B>A>C,故D错误.
故选:D.

练习册系列答案
相关题目
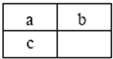 a、b、c三种短周期元素在元素周期表中的相对位置如图所示,a与b的质子数之和比c的质子数少1,以下说法错误的是( )
a、b、c三种短周期元素在元素周期表中的相对位置如图所示,a与b的质子数之和比c的质子数少1,以下说法错误的是( )| A、a与c均存在同素异形体 | B、原子半径由大到小的顺序为:c>a>b | C、b的氢化物的稳定性小于c的氢化物的稳定性 | D、c的单质可用于制造太阳能电池 |
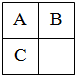 A、B、C三种短周期元素在周期表中的相对位置如右图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )
A、B、C三种短周期元素在周期表中的相对位置如右图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )| A、B与C均不存在同素异形体 | B、X一定是酸性氧化物 | C、B的氢化物比A、C的氢化物稳定 | D、Y与NaOH溶液反应只能生成两种盐 |
 (2009?三明一模)A、B、C三种短周期元素在周期表中位置如图示,B位于ⅥA族.下列叙述错误的是( )
(2009?三明一模)A、B、C三种短周期元素在周期表中位置如图示,B位于ⅥA族.下列叙述错误的是( )