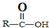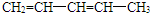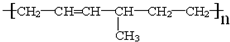题目内容
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程式为:2MnO4- +16H+ + 5Na2O2 ="===" 2Mn2+ +5O2↑ + 8H2O + 10Na+ 下列判断正确的是:
- A.高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂
- B.反应的氧化产物只有氧气
- C.当反应产生标准状况下2.24 L O2时,反应转移的电子为0.1mol
- D.向高锰酸钾溶液滴加浓盐酸可以得到酸性高锰酸钾溶液
B
该反应中高锰酸根中Mn从+7到+2价,做氧化剂,过氧化钠中O从-1价到0价,做还原剂。故A错误,B正确;该反应中转移10个电子,生成5mol氧气,故生成2.24L氧气,转移0.2mol电子,C错误;盐酸具有还原性,高锰酸钾具有强氧化性,不能用于酸化。
该反应中高锰酸根中Mn从+7到+2价,做氧化剂,过氧化钠中O从-1价到0价,做还原剂。故A错误,B正确;该反应中转移10个电子,生成5mol氧气,故生成2.24L氧气,转移0.2mol电子,C错误;盐酸具有还原性,高锰酸钾具有强氧化性,不能用于酸化。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
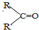
A、B、C、D、E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1:2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基).下列叙述错误的是( )
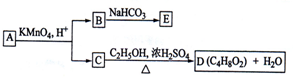

| A、B的结构简式为HOOC-CH2-COOH | B、C与乙醇发生了酯化反应 | C、A可以与氢氧化钠溶液发生中和反应 | D、E的分子式为C3H2O4Na2 |