题目内容
将15.6gNa2O2与2.7gAl粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。
(1)Na2O2与水反应的化学方程式为 ,
该反应中的转移电子的物质的量为 mol。
(2)反应结束时生成气体的体积在标准状况下为 L。
(3)取agNa2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为VL,则V的取值范围是 ,(用含a的代数式表示,结果可不化简)。
(1)Na2O2与水反应的化学方程式为 ,
该反应中的转移电子的物质的量为 mol。
(2)反应结束时生成气体的体积在标准状况下为 L。
(3)取agNa2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为VL,则V的取值范围是 ,(用含a的代数式表示,结果可不化简)。
(1)2Na2O2 +2H2O="4NaOH+" O2↑ 0.2 (2)5.6 (3) <V≤
<V≤
 <V≤
<V≤
(1)(2)略
(3)若固体物质全部是Na2O2,由2Na2O2 +2H2O="4NaOH+" O2↑可知放出的气体全部为O2,其体积为 L;固体物质是Na2O2和Al粉的混合物时,Na2O2与H2O反应后生成的NaOH恰好将Al粉全部溶解:2NaOH+2Al+2H2O =2NaAlO2+3H2↑,此时生成的气体体积最多。计算方法为:假设Al的物质的量为x,则Na2O2的物质的量应为
L;固体物质是Na2O2和Al粉的混合物时,Na2O2与H2O反应后生成的NaOH恰好将Al粉全部溶解:2NaOH+2Al+2H2O =2NaAlO2+3H2↑,此时生成的气体体积最多。计算方法为:假设Al的物质的量为x,则Na2O2的物质的量应为 x,生成的O2和H2物质的量分别为
x,生成的O2和H2物质的量分别为 x和
x和 x,则气体总物质的量为
x,则气体总物质的量为 x +
x + x=
x=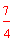 x。再由27 x+
x。再由27 x+ x×78=a,可求得x=
x×78=a,可求得x=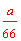 mol,其体积为
mol,其体积为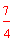 ×
×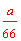 ×22.4=
×22.4= L
L
(3)若固体物质全部是Na2O2,由2Na2O2 +2H2O="4NaOH+" O2↑可知放出的气体全部为O2,其体积为
 L;固体物质是Na2O2和Al粉的混合物时,Na2O2与H2O反应后生成的NaOH恰好将Al粉全部溶解:2NaOH+2Al+2H2O =2NaAlO2+3H2↑,此时生成的气体体积最多。计算方法为:假设Al的物质的量为x,则Na2O2的物质的量应为
L;固体物质是Na2O2和Al粉的混合物时,Na2O2与H2O反应后生成的NaOH恰好将Al粉全部溶解:2NaOH+2Al+2H2O =2NaAlO2+3H2↑,此时生成的气体体积最多。计算方法为:假设Al的物质的量为x,则Na2O2的物质的量应为 x,生成的O2和H2物质的量分别为
x,生成的O2和H2物质的量分别为 x和
x和 x,则气体总物质的量为
x,则气体总物质的量为 x +
x + x=
x=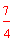 x。再由27 x+
x。再由27 x+ x×78=a,可求得x=
x×78=a,可求得x=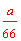 mol,其体积为
mol,其体积为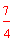 ×
×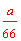 ×22.4=
×22.4= L
L
练习册系列答案
相关题目
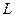 ,则溶液中溶质的质量分数可能是
,则溶液中溶质的质量分数可能是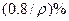
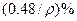
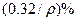
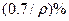
 %,该固体是( )
%,该固体是( )