题目内容
【题目】绿矾(FeSO47H2O)可用做净水剂、除草剂等。某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2,不考虑其它杂质)的含量并制备了绿矾,流程如下:
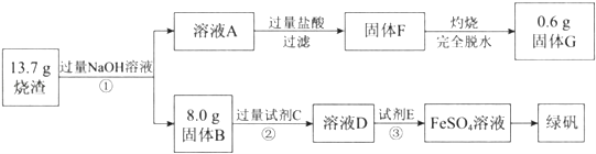
请回答下列问题:
(1)溶液A中含有的阴离子主要有AlO2-、SiO32-和______。
(2)试剂C是______。
(3)③中反应的离子方程式是_______、_______。
(4)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是______。
【答案】OH- 稀硫酸 Fe+2Fe3+=3Fe2+ Fe+2H+=Fe2++H2↑ 5:5:1
【解析】
烧渣主要成分为Fe2O3、Al2O3和SiO2,与过量NaOH溶液混合,Al2O3和SiO2反应产生NaAlO2、Na2SiO3进入溶液A中,Fe2O3不能反应进入滤渣,然后过滤得到的固体B为Fe2O3为8.0g,溶液A中含有Na+、AlO2-、SiO32-和OH-,加入过量盐酸,AlO2-转化为Al3+,SiO32-反应形成H2SiO3沉淀,发生反应的离子反应方程式为OH-+H+=H2O、AlO2-+4H+=Al3++2H2O、SiO32-+2H+=H2SiO3↓,然后过滤得到的固体F为H2SiO3沉淀,灼烧H2SiO3脱水分解得SiO2为0.6g;固体B为Fe2O3,向其中加过量试剂C溶解,因为要制备FeSO47H2O,所以试剂C为稀硫酸,发生反应Fe2O3+6H+=2Fe3++3H2O,所得溶液D为硫酸铁和过量稀硫酸的混合溶液,再加试剂E将三价铁还原成二价铁,则试剂E为Fe单质,最后将硫酸亚铁溶液进行蒸发浓缩、冷却结晶、过滤得到绿矾,据此分析。
(1)通过以上分析知,溶液A中含有的阴离子主要有AlO2-、SiO32-和OH-;
(2)固体B为Fe2O3,向其中加入H2SO4反应产生Fe2(SO4)3,再向该溶液中加入Fe粉,还原得到FeSO4溶液,因此试剂C是稀硫酸;
(3)③是Fe单质与Fe2(SO4)3反应产生FeSO4溶液,及与过量的H2SO4反应产生FeSO4和H2,其中反应的离子方程式是Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑;
(4)通过以上分析知Fe2O3为8.0g,,固体G是SiO2,由于在反应过程中Si元素没有损失,所以根据Si元素守恒,可知原混合物中含有SiO2为0.6g,则原混合物中Al2O3质量为m(Al2O3)=13.7g-8.0g-0.6g=5.1g,则烧渣中Fe2O3、Al2O3和SiO2的物质的量之比n(Fe2O3):n(Al2O3):n(SiO2)=![]() :
:![]() :
:![]() =0.05:0.05:0.01=5:5:1。
=0.05:0.05:0.01=5:5:1。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案