��Ŀ����
����Ŀ����ѧԭ������ѧ��ѧѧϰ����Ҫ���ݡ���ش��������⣺
��1���ټ�֪��CH4��H2��ȼ���ȣ���H���ֱ�Ϊ��890.3kJ/mol����285.8kJ/mol����CO2��H2��Ӧ����CH4���Ȼ�ѧ����ʽ��__________________________��
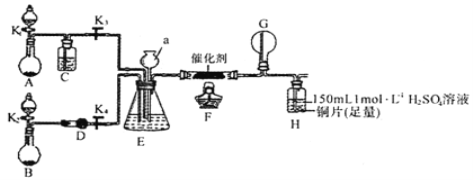
������������N2��H2Ϊ��Ӧ�������A��ϡ����Ϊ�������Һ��������������ṩ���ܣ����̵ܹ�������ȼ�ϵ�أ�װ����ͼ��ʾ����������ĵ缫��Ӧʽ��________��A��____��

��2���״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ�Ͽ��úϳ����Ʊ��״�����ӦΪCO��g��+2H2��g��![]() CH3OH��g����ij�¶������ݻ�Ϊ2L���ܱ������н��и÷�Ӧ����������ݼ�ͼ��
CH3OH��g����ij�¶������ݻ�Ϊ2L���ܱ������н��и÷�Ӧ����������ݼ�ͼ��

�ٴӷ�Ӧ��ʼ��ƽ��ʱ����CO��ʾ��ѧ��Ӧ����Ϊ________�����¶��µ�ƽ�ⳣ��Ϊ__��
��5min��10minʱ���ʱ仯��ԭ�������__________________��
��3���ٳ����£���V mL��0.1000mol/L����������Һ��μ��뵽20.00mL��0.1000mol/L������Һ�У���ַ�Ӧ��������Һ����ı仯���������ҺpH=7����ʱV��ȡֵ___20.00�����������=������������Һ��c��Na+����c��CH3COO������c��H+����c��OH�����Ĵ�С��ϵ��_____________________��
�ڳ����£���a mol/L�Ĵ�����b mol/L������������Һ�������ϣ���Ӧ����Һ�����ԣ������ĵ��볣��Ϊ_______���ú���a��b��ĸ�Ĵ���ʽ��ʾ����
���𰸡�CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=��252.9 kJ/mol N2+8H++6e��=2NH4+ �Ȼ�� 0.03mol/��Lmin�� 75/8 ��Ӧ���Ȼ�ʹ���˴��� �� c��Na+��=c��CH3COO������c��H+��=c��OH���� 10��7b/(a-b)
��������
��1���ٷֱ�д��CH4��H2��ȼ���ȵ��Ȼ�ѧ����ʽ�����ݸ�˹���ɽ��м����H��
�ڵ��������ʧ����,�ڸ�������������Ӧ,�����õ���������������ԭ��Ӧ,������HCl��Ӧ�����Ȼ��,��������ҺΪ�Ȼ����
��2����10minʱ��Ӧ����ƽ����ƽ��ʱCOΪ0.4mol���״�Ϊ0.6mol������Ϊ0.8mol������v=c/t����v(CO)������K=c(CH3OH)/c(CO)��c2(H2)����ƽ�ⳣ����
�ڷ�Ӧ�������С��������������࣬���ʼӿ죬�ı���������������»���������
��3������Һ��������Ǹ�����Һ��������Ũ��������������Ũ�ȵ���Դ�С�жϵ�,ֻҪ��Һ��c��H+��=c��OH��������Һ�ͳ��������������������������̶Ȳ�����NaOH��ǿ���������ȫ��������Ӧ���ɵ���������ǿ��������ˮ��ʼ���,����Һ������,���ټӼ���������Һ������c��H+��=c��OH����������ϵ���غ���н����
�ڳ�������c��H+��=c��OH����=10-7mol/L��c��Na+��=c��CH3COO����=bmol/L���ݴ˽���ƽ�ⳣ���ļ��㡣
��1���ټ����ȼ����Ϊ890.3kJ/mol���Ȼ�ѧ����ʽ��CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=��890.3 kJ/mol��H2��ȼ����Ϊ285.8kJ/mol���Ȼ�ѧ����ʽΪ��H2(g)+1/2O2(g)=H2O(l)����H=��285.8kJ/mol�����ݸ�˹���ɿ�֪������4-���ɵ���CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=-285.8��4+890.3=��252.9 kJ/mol������CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=��252.9 kJ/mol������������������ǣ�CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=��252.9 kJ/mol��
�ڸõ�صı��ʷ�Ӧ�Ǻϳɰ���Ӧ,���������ʧ����,�ڸ�������������Ӧ,�����õ���������������ԭ��Ӧ,��������ӦʽΪ��N2+8H++6e��=2NH4+��������HCl��Ӧ�����Ȼ������������ҺΪ�Ȼ����Һ��
��ˣ�������ȷ����: N2+8H++6e��=2NH4+���Ȼ����
(2)��10minʱ��Ӧ����ƽ��,ƽ��ʱCOΪ0.4mol���״�Ϊ0.6mol������Ϊ0.8mol,��v(CO)=(1-0.4)/(2��10)=0.03mol/��Lmin����ƽ�ⳣ��K=c(CH3OH)/c(CO)��c2(H2)= (0.6/2)/[0.4/2��(0.8/2)2]=75/8��
��ˣ�������ȷ������0.03mol/��Lmin���� 75/8��
��5minʱ��˲�����ֵ����ʵ���δ��������Ӧ���ʼӿ�,��Ӧ�����������С���������������������������ʹ���˴������������¶���
��ˣ�������ȷ����: ��Ӧ���Ȼ�ʹ���˴�����
��3���ٴ������������������̶Ȳ�����NaOH��ǿ���������ȫ����,��Ӧ���ɵ���������ǿ����������ˮ��ʼ����������Һ������pH=7�����ټӼ������Գ�����, ��V mL��0.1000mol/L����������Һ��μ��뵽20.00mL��0.1000mol/L������Һ�У���ַ�Ӧ����ʱV��ȡֵС��20.00 mL����Һ�����ԣ�c��H+��=c��OH���������ݵ���غ���c(Na+)+ c(H+)= c(CH3COO��)+ c(OH��)������c��Na+��=c��CH3COO������������Һ�е�����Ϊ��������Һ��ˮ�ĵ���������,������Һ��c��Na+����c��CH3COO������c��H+����c��OH�����Ĵ�С��ϵ��c��Na+��=c��CH3COO������c��H+��=c��OH����������������������ǣ�����c��Na+��=c��CH3COO������c��H+��=c��OH������
�ڷ�Ӧ����Һ��������c��H+��=c��OH��=10-7mol/L��c��Na+��=c��CH3COO����=bmol/L�������ĵ��볣��Ϊ=c(H+)c(CH3COO-)/c(CH3COOH)=10-7��b/(a-b)= 10��7b/(a-b)��
�������������������10��7b/(a-b)��