题目内容
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为________。
(2)丙酮(CH3CCH3O)分子中碳原子轨道的杂化类型是________,1 mol丙酮分子中含有σ键的数目为________。
(3)C、H、O三种元素的电负性由小到大的顺序为__________________。
(4)乙醇的沸点高于丙酮,这是因为________________________________________。
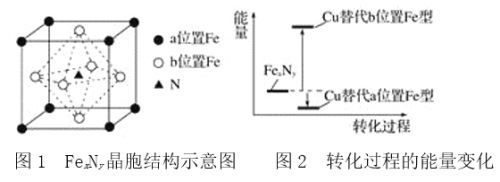
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。
【答案】[Ar]3d5或1s22s22p63s23p63d5 sp2和sp3 9NA H<C<O 乙醇分子间存在氢键 Fe3CuN
【解析】
铁的原子序数为26,位于第四周期Ⅷ族,Fe3+核外电子数为23,其基态核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5 ;答案:[Ar]3d5或1s22s22p63s23p63d5 。
(2)丙酮的甲基中碳原子的杂化方式为sp3杂化,羰基中碳原子的杂化方式为 sp2杂化;1mol丙酮中含有6molC-H键,2molC-C键,1molC=O键,单键均为σ键,碳氧双键中含有1molσ键,所以1mol丙酮中含有9molσ键。答案:sp2和sp3 、 9NA。
(3)电负性是原子在分子中吸引成键电子的能力。同周期元素的电负性随原子序数的增大而增大,所以电负性C<O,又因为在甲烷中碳元素显负化合价,吸引电子能力更强,所以电负性H<C,故电负性H<C<O 。答案:H<C<O。
(4)丙酮分子间只有范德华力,而乙醇存在分子间氢键,使其沸点升高。答案:乙醇分子间存在氢键。
(5)由晶胞示意图可知,一个FexNy晶胞中,含有铁原子的数目为1/2![]() +1/8
+1/8![]() =4氮原子的数目为1,所以x=4,y=1,由图-2可知,Cu替代该晶体中a位置Fe,可使能量降低,Cu替代该晶体中b位置Fe,可使能量升高,最稳定的Cu替代型产物为Cu完全替代该晶体中a位置Fe,即晶格中铜原子数目为1/8
=4氮原子的数目为1,所以x=4,y=1,由图-2可知,Cu替代该晶体中a位置Fe,可使能量降低,Cu替代该晶体中b位置Fe,可使能量升高,最稳定的Cu替代型产物为Cu完全替代该晶体中a位置Fe,即晶格中铜原子数目为1/8![]() 8=1,所以铁原子数目为3,所以最稳定的Cu替代型产物化学式为Fe3CuN。答案:Fe3CuN
8=1,所以铁原子数目为3,所以最稳定的Cu替代型产物化学式为Fe3CuN。答案:Fe3CuN