题目内容
填写空格
(1)写出下列物质的电子式:N2______;HClO______;
(2)写出下列物质的结构式:CH4______; CO2______.
(3)与Ar原子电子层结构相同的-2价阴离子的离子结构示意图______.
(4)在1-18号元素组成的化合物中具有三核10个电子的共价化合物是______;具有三核20个电子的离子化合物是______;具有四核18个电子的两种化合物分别是______、______;既具有离子键又有非极性键和极性键的化合物是______.
(5)下列叙述中所涉及元素是氧元素的有______
a.质量数为18,原子核中有10个中子的核素
b.核电荷数等于最外层电子数的离子
c.质子数等于短周期同族元素原子序数一半的元素
d.原子的最外层电子数是内层电子数3倍的元素
e.能与H、C、N、Na、S、Fe等元素形成两种或两种以上的化合物的元素
f.形成化合物的种类最多的元素
g.Y和Z均由元素R组成,反应Y+2I-+2H+

I2+Z+H2O,其中的R元素.
(1)写出下列物质的电子式:N2______;HClO______;
(2)写出下列物质的结构式:CH4______; CO2______.
(3)与Ar原子电子层结构相同的-2价阴离子的离子结构示意图______.
(4)在1-18号元素组成的化合物中具有三核10个电子的共价化合物是______;具有三核20个电子的离子化合物是______;具有四核18个电子的两种化合物分别是______、______;既具有离子键又有非极性键和极性键的化合物是______.
(5)下列叙述中所涉及元素是氧元素的有______
a.质量数为18,原子核中有10个中子的核素
b.核电荷数等于最外层电子数的离子
c.质子数等于短周期同族元素原子序数一半的元素
d.原子的最外层电子数是内层电子数3倍的元素
e.能与H、C、N、Na、S、Fe等元素形成两种或两种以上的化合物的元素
f.形成化合物的种类最多的元素
g.Y和Z均由元素R组成,反应Y+2I-+2H+

I2+Z+H2O,其中的R元素.
(1)N2是以共价键作用结合成的单质分子,N原子间通过三对共用电子对结合,N2的电子式为
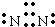
,
HClO是共价化合物,氧原子为中心原子,分别与氯原子、氢原子通过一对共用电子对结合,HClO的电子式为

,
故答案为:
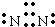
;

;
(2)CH4的电子式为
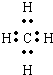
,结构式为
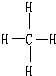
,CO2的电子式为
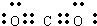
,结构式为O═C═O;
故答案为:
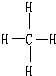
;O═C═O;
(3))-2价阴离子与与Ar原子电子层结构相同,则核外电子数相等为18个电子,-2价阴离子的核内质子数是16,其结构示意图为
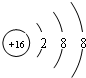
,故答案为:

;
(4)在1-18号元素组成的化合物中具有三核10个电子的共价化合物为H2O;
Na+和OH-都是10个电子的离子,结合得到具有三核20个电子的离子化合物是NaOH,H2S是18个电子,用Li替代三核20个电子的离子化合物LiHS;
将H2O去掉一个H原子,将剩余部分结合可得四核18个电子的化合物H2O2,NH3是四核10个电子,P比N多8个电子,用P替代N,可得四核18个电子的化合物PH3;
有机酸形成的盐既具有离子键又有非极性键和极性键,满足条件的化合物是CH3COONa等;
故答案为:H2O;LiHS或NaOH; H2O2、PH3;CH3COONa.
(5)a、质量数为18,中子数为10的核素,质子数Z=18-10=8,属于氧元素,故a正确;
b、原子失电子形成阳离子,阳离子核电荷数一定大于最外层电子数,核电荷数等于最外层电子数的离子为阴离子,阴离子的最外层电子数是2或8,最外层电子数为2是H-,核电荷数不等于最外层电子数;最外层电子数为8时,核电荷数为8,是O2-,故b正确;
c、质子数等于短周期同族元素原子序数一半,应处于偶数族,ⅡA族、ⅣA族、ⅥA族,这3族原子序数相差8,所以原子处于ⅥA族,故为氧原子,属于氧元素,故c正确;
d、原子的最外层电子数是内层电子数3倍的元素,该原子有两个电子层,第一电子层有2个电子,最外层有6个电子,所以核内有8个质子,是氧原子,属于氧元素,故d正确;
e、能与H、C、N、Na、S、Fe等元素形成两种或两种以上的化合物的元素,该元素为非金属元素,显负化合价,有变价,只有氧元素符合,故e正确;
f、形成化合物的种类最多的元素是碳元素,故f错误;
g、由反应Y+2I-+2H+

I2+Z+H2O,根据质量守恒可知,Y含有氧元素,Y和Z均由元素R组成,所以R为氧元素,故g正确.
故答案为:abcdeg.
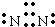
,
HClO是共价化合物,氧原子为中心原子,分别与氯原子、氢原子通过一对共用电子对结合,HClO的电子式为

,
故答案为:
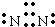
;

;
(2)CH4的电子式为
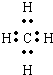
,结构式为
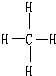
,CO2的电子式为
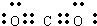
,结构式为O═C═O;
故答案为:
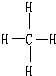
;O═C═O;
(3))-2价阴离子与与Ar原子电子层结构相同,则核外电子数相等为18个电子,-2价阴离子的核内质子数是16,其结构示意图为

,故答案为:

;
(4)在1-18号元素组成的化合物中具有三核10个电子的共价化合物为H2O;
Na+和OH-都是10个电子的离子,结合得到具有三核20个电子的离子化合物是NaOH,H2S是18个电子,用Li替代三核20个电子的离子化合物LiHS;
将H2O去掉一个H原子,将剩余部分结合可得四核18个电子的化合物H2O2,NH3是四核10个电子,P比N多8个电子,用P替代N,可得四核18个电子的化合物PH3;
有机酸形成的盐既具有离子键又有非极性键和极性键,满足条件的化合物是CH3COONa等;
故答案为:H2O;LiHS或NaOH; H2O2、PH3;CH3COONa.
(5)a、质量数为18,中子数为10的核素,质子数Z=18-10=8,属于氧元素,故a正确;
b、原子失电子形成阳离子,阳离子核电荷数一定大于最外层电子数,核电荷数等于最外层电子数的离子为阴离子,阴离子的最外层电子数是2或8,最外层电子数为2是H-,核电荷数不等于最外层电子数;最外层电子数为8时,核电荷数为8,是O2-,故b正确;
c、质子数等于短周期同族元素原子序数一半,应处于偶数族,ⅡA族、ⅣA族、ⅥA族,这3族原子序数相差8,所以原子处于ⅥA族,故为氧原子,属于氧元素,故c正确;
d、原子的最外层电子数是内层电子数3倍的元素,该原子有两个电子层,第一电子层有2个电子,最外层有6个电子,所以核内有8个质子,是氧原子,属于氧元素,故d正确;
e、能与H、C、N、Na、S、Fe等元素形成两种或两种以上的化合物的元素,该元素为非金属元素,显负化合价,有变价,只有氧元素符合,故e正确;
f、形成化合物的种类最多的元素是碳元素,故f错误;
g、由反应Y+2I-+2H+

I2+Z+H2O,根据质量守恒可知,Y含有氧元素,Y和Z均由元素R组成,所以R为氧元素,故g正确.
故答案为:abcdeg.

练习册系列答案
相关题目
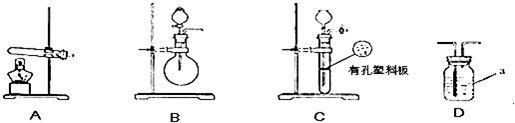
在呼吸面具和潜水艇中可以用过氧化钠作为供氧剂。某化学探究学习小组选用适当的化学试剂和实验用品,用下图中实验装置,进行实验来证明过氧化钠可作供氧剂。其中,A是实验室制取CO2的装置,D中装有过氧化钠固体。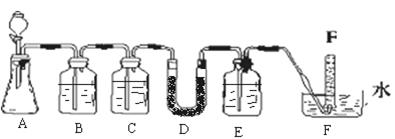
(1)写出A装置中发生反应的离子方程式: ;
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | | 除去CO2中的水蒸气 |
| E | | |
原因 ;
(4)试管F中收集满气体并从水中取出后,下一步实验操作为: 。
在呼吸面具和潜水艇中可以用过氧化钠作为供氧剂。某化学探究学习小组选用适当的化学试剂和实验用品,用下图中实验装置,进行实验来证明过氧化钠可作供氧剂。其中,A是实验室制取CO2的装置,D中装有过氧化钠固体。

(1)写出A装置中发生反应的离子方程式: ;
(2)填写表中空格:
|
仪器 |
加入试剂 |
加入该试剂的目的 |
|
B |
饱和NaHCO3溶液 |
|
|
C |
|
除去CO2中的水蒸气 |
|
E |
|
|
(3)若无C装置,对实现该实验目的是否有影响 (填“是”或“否”),
原因 ;
(4)试管F中收集满气体并从水中取出后,下一步实验操作为: 。