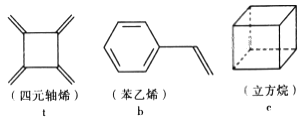
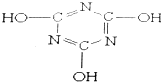
题目内容
【题目】某小组为研究电化学原理,设计如图装置,下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铁片上发生的反应为: Fe2e===Fe2+
C. a和b用导线连接时,电子从Cu片流向铁片
D. a和b用导线连接时,Cu2+向铜电极移动
【答案】C
【解析】A、a和b不连接时,该装置不是原电池,铁片上会有金属铜析出,选项A正确;B、a和b用导线连接时,该装置是原电池,铁片做为负极,发生的反应为:Fe-2e-= Fe2+,选项B正确;C、a和b用导线连接时,该装置是原电池,铁片做为负极,电子从负极铁片流向正极铜片,选项C错误;D、a和b用导线连接时,该装置是原电池,原电池中阳离子Cu2+向正极铜电极移动,选项D正确。为本题的正确答案。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10