题目内容
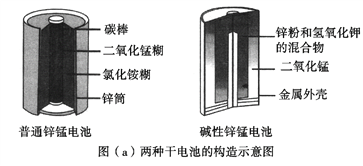
【题目】锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。
回答下列问题:
(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2==Zn(NH3)2Cl2+2MnOOH
①该电池中,负极材料主要是________,电解质的主要成分是________,正极发生的主要反应是__________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点有_____________________。(任写一条)
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
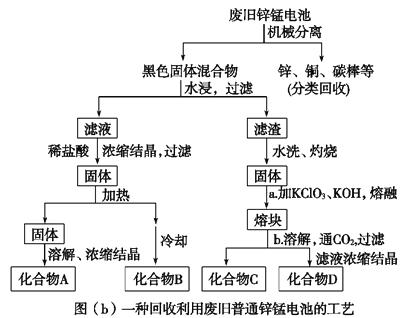
图(b)中产物的化学式分别为A_________________,B______________________。
(3)①操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液D和一种黑褐色固体C,该反应的离子方程式为_________________________。
②采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是________。(填化学式)
【答案】 Zn NH4Cl MnO2+NH![]() +e-===MnOOH+NH3 碱性电池比能量高;可储存时间长;或碱性电池使用寿命长(因为金属材料在碱性电解质比在酸性电解质的稳定性好);碱性电池不容易发生电解质溶液泄漏(因为消耗的负极改装在电池的内部) ZnCl2 NH4Cl 3MnO
+e-===MnOOH+NH3 碱性电池比能量高;可储存时间长;或碱性电池使用寿命长(因为金属材料在碱性电解质比在酸性电解质的稳定性好);碱性电池不容易发生电解质溶液泄漏(因为消耗的负极改装在电池的内部) ZnCl2 NH4Cl 3MnO![]() +2CO2===2MnO
+2CO2===2MnO![]() +MnO2↓+2CO
+MnO2↓+2CO![]() H2
H2
【解析】(1)①根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,反应中Zn被氧化,为电池负极锌,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO2+NH4++e-=MnOOH+NH3,故答案为:锌;NH4Cl;MnO2+NH4++e-=MnOOH+NH3;
②与普通锌锰电池相比,碱性锌锰电池的优点有:碱性电池比能量高;可储存时间长;或碱性电池使用寿命长;碱性电池不容易发生电解质溶液泄漏等,故答案为:碱性电池不易发生电解质的泄露、碱性电池的使用寿命较长、碱性电池比能量高等;
(2)废电池经机械分离后,加水溶解后溶液中的成分是氯化铵,再加稀盐酸Zn溶解生成氯化锌,因此浓缩结晶得到氯化铵和氯化锌,氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌,故答案为:ZnCl2 ;NH4Cl;
(3)①绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,该反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-,故答案为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-
②采用惰性电极电解K2MnO4溶液生成高锰酸钾发生氧化反应,则阴极发生还原反应,溶液中的氢离子得电子生成氢气,故答案为:H2。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案