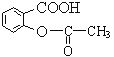题目内容
【题目】下列有关实验原理的说法中正确的是![]()
![]()
①探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低
②在试管中加入3~5mL稀盐酸,再用胶头滴管逐滴加入![]() 溶液,即可制得硅酸胶体
溶液,即可制得硅酸胶体
③在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度
④用标准酸液、甲基橙试液、pH计、滴定管![]() 酸式和碱式
酸式和碱式![]() 、锥形瓶、蒸馏水等主要仪器和药品即可完成某一未知浓度氨水电离程度的测定实验
、锥形瓶、蒸馏水等主要仪器和药品即可完成某一未知浓度氨水电离程度的测定实验
A.①②B.③④C.①④D.②③
【答案】C
【解析】
![]() 探究温度对硫代硫酸钠与硫酸反应速率的影响时,必须在恒温条件下进行,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低,故
探究温度对硫代硫酸钠与硫酸反应速率的影响时,必须在恒温条件下进行,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低,故![]() 正确;
正确;
![]() 在试管中加入3~5mL稀盐酸,再用胶头滴管逐滴加入
在试管中加入3~5mL稀盐酸,再用胶头滴管逐滴加入![]() 溶液,会生成硅酸沉淀,故
溶液,会生成硅酸沉淀,故![]() 错误;
错误;
![]() 起始温度应为混合前酸、碱的温度,然后混合后测定最高温度,以此计算中和热,故
起始温度应为混合前酸、碱的温度,然后混合后测定最高温度,以此计算中和热,故![]() 错误;
错误;
![]() 用标准酸液、甲基橙试液、滴定管
用标准酸液、甲基橙试液、滴定管![]() 酸式和碱式
酸式和碱式![]() 、锥形瓶、蒸馏水等主要仪器和药品可先测出氨水的浓度,再用pH计测出溶液的pH,进而求出氨水中氢离子的浓度,可计算氨水电离程度,故
、锥形瓶、蒸馏水等主要仪器和药品可先测出氨水的浓度,再用pH计测出溶液的pH,进而求出氨水中氢离子的浓度,可计算氨水电离程度,故![]() 正确;
正确;
故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目