题目内容
 减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求.
减少NO2、SO2、CO等有害气体对大气环境的危害,是人类的共同追求.(1)在原子经济学原则引导下,化学家用CO与H2在加热加压条件合成了液体燃料甲醇,其化学反应方程式为
CO+2H2
CH3OH
| ||
| 加压 |
CO+2H2
CH3OH
.
| ||
| 加压 |
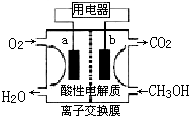
(2)以甲醇做燃料的电池,如图所示,其负极是
b
b
(填a或b),负极的反应式为
CH3OH-6e-+H2O=CO2+6H+
CH3OH-6e-+H2O=CO2+6H+
,正极的反应式为_O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
.该燃料电池在理想状态下,将有96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,则通常甲醇燃烧的热化学反应方程式为
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-727.6kJ/mol
| 3 |
| 2 |
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-727.6kJ/mol
.| 3 |
| 2 |
(3)已知:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=+41.8kJ?mol-1 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
b
b
.a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1molNO2
当上述反应平衡时,测得NO2与SO2体积比为1:6,则平衡常数K=
| 8 |
| 3 |
| 8 |
| 3 |
当给已达平衡状态的上述反应升温时,平衡常数K′
变大
变大
.(变大、变小或不变)分析:(1)根据CO与H2在加热加压条件合成甲醇写出反应方程式;
(2)燃料电池中通入燃料的一极为负极,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,该燃料电池的电解质溶液呈酸性,所以负极上甲醇失电子和水反应生成二氧化碳和氢离子,氧气在正极上生成水;96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,燃烧1mol液体甲醇放出热量为:
,然后写出其热化学方程式;
(3)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数,△H>0,升高温度平衡正移,K变大.
(2)燃料电池中通入燃料的一极为负极,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,该燃料电池的电解质溶液呈酸性,所以负极上甲醇失电子和水反应生成二氧化碳和氢离子,氧气在正极上生成水;96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,燃烧1mol液体甲醇放出热量为:
| 702.1kJ |
| 96.5% |
(3)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数,△H>0,升高温度平衡正移,K变大.
解答:解:(1)根据CO与H2在加热加压条件合成甲醇写出方程为CO+2H2
CH3OH,故答案为:CO+2H2
CH3OH;
(2)燃料电池中通入燃料的一极为负极,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,该燃料电池的电解质溶液呈酸性,所以负极上甲醇失电子和水反应生成二氧化碳和氢离子,负极反应式为CH3OH-6e-+H2O=CO2+6H+,氧气在正极上生成水,正极电极反应式为:O2+4e-+4H+═2H2O;
96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,燃烧1mol液体甲醇放出热量为
=727.6KJ,其热化学方程式为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-727.6kJ/mol,
故答案为:b;CH3OH-6e-+H2O=CO2+6H+;O2+4e-+4H+═2H2O;CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-727.6kJ/mol;
(3)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(a-x):(2a-x)=1:6,故x=
a,故平衡常数K=
=
=
=
,
已知△H>0,升高温度平衡正移,K变大,
故答案为:b;
;变大.
| ||
| 加压 |
| ||
| 加压 |
(2)燃料电池中通入燃料的一极为负极,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,该燃料电池的电解质溶液呈酸性,所以负极上甲醇失电子和水反应生成二氧化碳和氢离子,负极反应式为CH3OH-6e-+H2O=CO2+6H+,氧气在正极上生成水,正极电极反应式为:O2+4e-+4H+═2H2O;
96.5%的化学能转化成电能,即消耗1mol液体甲醇所能产生的最大电能达702.1kJ,燃烧1mol液体甲醇放出热量为
| 702.1kJ |
| 96.5% |
| 3 |
| 2 |
故答案为:b;CH3OH-6e-+H2O=CO2+6H+;O2+4e-+4H+═2H2O;CH3OH(l)+
| 3 |
| 2 |
(3)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(a-x):(2a-x)=1:6,故x=
| 4 |
| 5 |
| C(SO3)C(NO) |
| c(NO2)C(SO2) |
| x 2 |
| (a-x)(2a-x) |
| 16 |
| 25 |
| 8 |
| 3 |
已知△H>0,升高温度平衡正移,K变大,
故答案为:b;
| 8 |
| 3 |
点评:本题考查了化学平衡常数的计算,热化学方程式的书写,原电池原理,明确燃料电池中正负极上得失电子,题目综合性较强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目