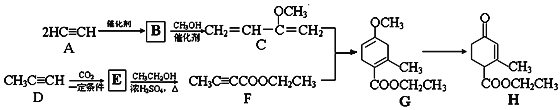
题目内容
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子外围电子轨道表示式为____________________,铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用_________摄取铁元素的原子光谱。
(2)FeCoOx是一种新型光电催化剂。第四电离能大小关系是I4(Co)____I4(Fe)(填“>”或“<” ) ,原因是_____________。
(3)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249 ℃,易升华,难溶于水,易溶于有机溶剂,它属于_____________晶体。
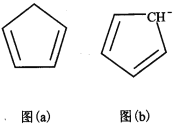
(4)环戊二烯(C5H6)结构如图(a),可用于制二茂铁。环戊二烯中碳原子的杂化方式为________。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H5―)结构如图(b),其中的大π键可以表示为_________________。
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H5―)结构如图(b),其中的大π键可以表示为_________________。
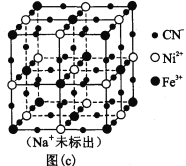
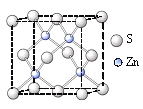
(5)某普鲁士蓝类配合物可作为新型钠离子电池电极材料。它由Na+、Ni2+、Fe3+和CN―构成,其晶胞结构如图(c)。该物质中,不存在________(填标号)。A.离子键 B. σ键 C. π键 D. 氢键 E. 金属键
(6)该晶胞中Fe3+采用的堆积方式与_______(选填Po、Na、Mg、Cu)相同,单个晶胞的配位空隙中共容纳_____个 Na+。
【答案】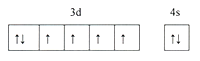 光谱仪 < 铁失去的是处于半充满状态的3d5的一个电子,相对较难;钴失去3d6上的一个电子后形成稳定的半充满状态,相对容易 分子 sp2 sp3
光谱仪 < 铁失去的是处于半充满状态的3d5的一个电子,相对较难;钴失去3d6上的一个电子后形成稳定的半充满状态,相对容易 分子 sp2 sp3 ![]() DE Cu 4
DE Cu 4
【解析】
(1)铁原子序数为26,由构造原理可知,铁原子核外电子排布式为1s22s22p63s23p63d6 4s2,外围电子排布式为3d64s2,据此写出轨道表示式;
核外电子发生跃迁时会吸收或释放不同的光,形成光谱,可以用光谱仪获取原子光谱;
(2)Co原子序数为27,Co3+核外电子排布式为1s22s22p63s23p63d6、Fe3+核外电子排布式为1s22s22p63s23p63d5,为半充满的稳定状态,失去电子较难,需要较高能量,据此分析解答;
(3)根据该晶体的物理性质分析判断晶体类型;
(4)根据环戊二烯(C5H6)的结构式、结合C原子四键规律分析C原子的杂化类型;由环戊二烯负离子(C5H5-)结构图可知,环戊二烯负离子,由两个双键和一个负电荷组成环状共轭体系,π电子数是6,即六个π电子,据此写出大π键符号;
(5)分析构成普鲁士蓝类配合物的粒子可知,该物质是离子化合物,含有CN-,CN-中存在C≡N三键;
(6)抽出晶胞中Fe3+和CN-可知,晶胞中Ni2+位于体心和棱心位置,配位数是12,晶胞中含有Ni2+数目为12×![]() +1=4,是面心立方最密堆积,类似于Cu晶胞;晶胞中Fe3+的数目为8×
+1=4,是面心立方最密堆积,类似于Cu晶胞;晶胞中Fe3+的数目为8×![]() +6×
+6×![]() =4,CN-的数目为24×
=4,CN-的数目为24×![]() +24×
+24×![]() +6=24,结合化合物中阴阳离子电荷数相等推断Na+的数目。
+6=24,结合化合物中阴阳离子电荷数相等推断Na+的数目。
铁原子序数为26,核外电子排布式为1s22s22p63s23p63d6 4s2,外围电子排布式3d6 4s2,外围电子轨道排布式为 ;核外电子发生跃迁时会吸收或释放不同的光,形成光谱,可以用光谱仪获取原子光谱,
;核外电子发生跃迁时会吸收或释放不同的光,形成光谱,可以用光谱仪获取原子光谱,
故答案为: ;光谱仪;
;光谱仪;
(2)Co3+核外电子排布式为1s22s22p63s23p63d6,不是特殊结构,失去一个电子形成1s22s22p63s23p63d5结构需要能量不大,Fe3+核外电子排布式为1s22s22p63s23p63d5,是半充满的稳定结构,再失去一个电子形成不稳定结构需要较高能量,所以I4(Co)<I4(Fe),
故答案为:<;铁离子失去处于半充满3d5的一个电子,相对困难,钴离子失去3d6上的一个电子形成较稳定的半充满状态,相对容易;
(3)二茂铁晶体熔沸点不高、易升华、易溶于有机溶剂,符合分子晶体特征,所以该晶体为分子晶体,
故答案为:分子;
(4)由环戊二烯(C5H6)的结构式可知,环戊二烯中有4个C原子形成有C=C双键,1个C原子含有4个CH单键,即有两种C原子,所以杂化类型为sp2和sp3;由环戊二烯负离子(C5H5)结构图可知,环戊二烯负离子,由两个双键和一个负电荷组成环状共轭体系,π电子数是6,即形成5个碳原子、6个π电子的大π键,符号为![]() ,
,
故答案为:sp2、sp3;![]() ;
;
(5)普鲁士蓝类配合物由Na+、Ni2+、Fe3+和CN构成,是离子化合物,存在离子键,含有CN,CN中存在C≡N三键,一个C≡N由1个σ键和2个π键组成,化合物中不存在氢键和金属键,
故答案为:DE;
(6)抽出晶胞中Fe3+和CN可知,晶胞中Ni2+位于体心和棱心位置,配位数是12,晶胞中含有Ni2+数目为12×![]() +1=4,为面心立方最密堆积,类似于Cu晶胞;晶胞中Fe3+的数目为8×
+1=4,为面心立方最密堆积,类似于Cu晶胞;晶胞中Fe3+的数目为8×![]() +6×
+6×![]() =4,CN的数目为24×
=4,CN的数目为24×![]() +24×
+24×![]() +6=24,化学式为NaxNi4Fe4(CN)24,由于化合物中阴阳离子电荷数相等,x+4×2+4×3=24×1,解得x=4。即单个晶胞的配位空隙中共容纳Na+的数目为4,
+6=24,化学式为NaxNi4Fe4(CN)24,由于化合物中阴阳离子电荷数相等,x+4×2+4×3=24×1,解得x=4。即单个晶胞的配位空隙中共容纳Na+的数目为4,
故答案为:Cu;4。

 名校课堂系列答案
名校课堂系列答案