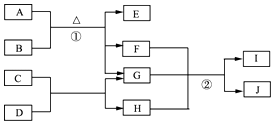
��Ŀ����
����Ŀ��2.48g��ͭ�Ͻ���ȫ�ܽ���80mL 4.0molL��1ϡ�����У��õ���״����672mL NO���壨�����ʱ���������������������˵����ȷ���ǣ� ��
A.ȡ��Ӧ����Һ�����뼸��KSCN��Һ����Ѫ��ɫ����
B.�úϽ�������ͭ�����ʵ���֮����1��2
C.��Ӧ����Һ��������Һ����仯����c��H+��=2.5 molL��1
D.��Ӧ�����Һ�м���2.0 molL��1NaOH��Һ����������ǡ��ȫ������ʱ�������NaOH��Һ�������120 mL
���𰸡�C
���������⣺��Ӧ����672mL��NO���壬�����ʵ���= ![]() =0.03mol��ת�Ƶ������ʵ���=0.03mol��3=0.09mol�����������������������������������
=0.03mol��ת�Ƶ������ʵ���=0.03mol��3=0.09mol����������������������������������� ![]() �����Բμӷ�Ӧ����������ʵ���Ϊ��0.03mol��4=0.12mol����80mL 4.0molL��1ϡ��������������ʵ���Ϊ��0.32mol�������������������ͭ��ȫ��Ӧ����ת��Ϊ�����ӣ�������������ͭ�����ʵ����ֱ�Ϊxmol��ymol�����ݶ������������ת���غ㣬��
�����Բμӷ�Ӧ����������ʵ���Ϊ��0.03mol��4=0.12mol����80mL 4.0molL��1ϡ��������������ʵ���Ϊ��0.32mol�������������������ͭ��ȫ��Ӧ����ת��Ϊ�����ӣ�������������ͭ�����ʵ����ֱ�Ϊxmol��ymol�����ݶ������������ת���غ㣬��
![]()
���x=0.01��y=0.03��
A����ת��Ϊ��������������Ӧ����Һ�е��뼸��KSCN��Һ����Һ��Ѫ��ɫ����A����
B���úϽ�������ͭ�����ʵ���֮����1��3����B����
C����Ӧ����Һ��������Һ����仯����c��H+��= ![]() =2.5 molL��1 �� ��C��ȷ��
=2.5 molL��1 �� ��C��ȷ��
D��������ȫ�����õ���������Һ������������غ��֪�������NaOH�����ʵ���Ϊ��0.32��0.12=0.2mol������V= ![]() =0.1L=100ml����D����
=0.1L=100ml����D����
��ѡC��

����Ŀ����������(ClO2)�Ǽ�������ˮ�Ҳ���ˮ������ѧ��Ӧ�Ļ���ɫ���壬�е�Ϊ11�棬�����ڴ��������ˮ��ijС����ʵ������̽��ClO2��Na2S�ķ�Ӧ���ش���������:
��1��ClO2���Ʊ�:
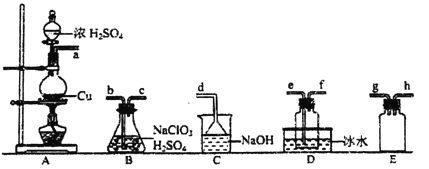
��֪:SO2+2NaClO3+H2SO4=2ClO2��+2NaHSO4
��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ__________��
�����ռ�ClO2��ѡ����ͼ�е�װ�ã�������˳��Ϊa��__________(������������Сд��ĸ��ʾ)��
��װ��D��������___________________��
��2��C1O2��Na2S�ķ�Ӧ

�������ռ�����ClO2��N2ϡ������ǿ���ȶ��ԣ�����������ϡ�ͺ��ClO2ͨ����ͼ��ʾװ���г�ַ�Ӧ���õ���ɫ������Һ��һ��ʱ���ͨ������ʵ��̽��I�з�Ӧ�IJ��
�������� | ʵ������ | ���� |
ȡ����I����Һ���Թܼ��У��μ�Ʒ����Һ�����ᡣ | Ʒ��ʼ�ղ���ɫ | ����_________���� |
��ȡ����I����Һ���Թ�����������Ba(OH)2��Һ���� | ��____________ | ��SO42-���� |
���������Թ����еμ�Ba(OH)2��Һ�����������ã�ȡ�ϲ���Һ���Թܱ�����_______�� | �а�ɫ�������� | ��Cl-���� |
��ClO2��Na2S�ķ�Ӧ�����ӷ���ʽΪ______________�����ڴ��������ˮʱ��ClO2�����Cl2���ŵ���_________________(��дһ��)��