题目内容
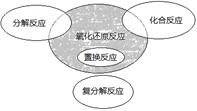
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不包含氧化还原反应的是
| A.金属锈蚀 | B.海水晒盐 | C.食物腐败 | D.燃放鞭炮 |
B
试题分析:A、金属锈蚀发生电化学腐蚀,属于化学变化过程,涉及氧化还原反应,错误;B、海水晒盐不属于氧化还原反应,正确;C、食物的腐败是食物缓慢氧化变质的过程,属于氧化还原反应,错误;D、燃放鞭炮是剧烈的氧化还原反应过程,错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
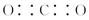
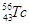
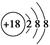
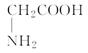

 H2SO3 + OH– 和 ② (写出离子方程式)
H2SO3 + OH– 和 ② (写出离子方程式)