题目内容
(08宝鸡质量检测,12)下列装置中发生的总反应为2AL+6H+=2AL3++3H2↑的是(铝条表面的氧化膜均已除去):
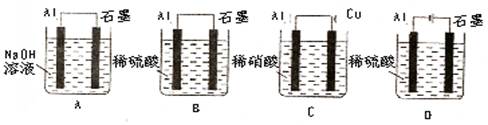

B
本题考查原电池和电解池,较难题。A为原电池,总反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑;C为原电池,总反应为:Al+4H++NO3-=Al3++NO↑+2H2O;D项为电解池,总反应为:2H2O=2H2↑+O2↑。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
题目内容


 快乐5加2金卷系列答案
快乐5加2金卷系列答案