题目内容
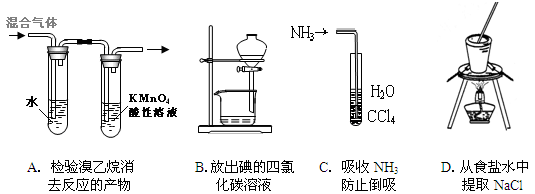
下列实验操作不正确的是
| A.制摩尔盐时用酒精洗涤产品,而在制阿司匹林时用水洗涤产品 |
| B.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌 |
| C.在海带中提取碘的实验中既可以用四氯化碳作萃取剂也可以用酒精作萃取剂 |
| D.如果皮肤上不慎沾有苯酚,应立即用酒精清洗,不可用NaOH溶液冲洗 |
C
本题考查的是化学实验的有关内容。在海带中提取碘的实验中只能用四氯化碳作萃取剂,不可用酒精作萃取剂。C错。故本题选C。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目

 ;
;