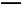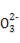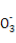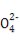题目内容
原子序数小于36的X、Y、Z、W四种元素,元素X的原子核外最外层电子数是内层电子数的2倍,元素Y与X同周期,其基态原子占据s轨道的电子数与占据p轨道的电子数相同,Z是X的同族相邻元素;W是第Ⅷ族元素中原子序数最小的元素。用元素符号回答下列问题:
(1)X、Y、Z的电负性由小到大的顺序是 。
(2)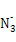 与X、Y形成的一种化合物互为等电子体,则
与X、Y形成的一种化合物互为等电子体,则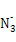 的空间构型为 、电子式为 。
的空间构型为 、电子式为 。
(3)同为原子晶体的ZX与ZY2中硬度小的是 。
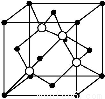
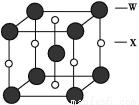
(4)X和W所形成的某种晶体结构如图所示,写出:
①基态W2+的价电子排布式 ;
②该晶体的化学式 。
(1)Si<C<O(2分)
(2)直线形(2分) 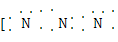 ]-(3分)
]-(3分)
(3)SiO2(3分)
(4)①3d6(2分) ②FeC(3分)
【解析】根据元素的结构及有关性质可知,X、Y、Z、W四种元素分别是C、O、Si、Fe。
(1)非金属性越强,电负性越大,所以X、Y、Z的电负性由小到大的顺序是Si<C<O。
(2)价电子数和原子数分别都相等的是等电子体,所以与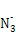 互为等电子体的是CO2,因此和CO2类似,N
互为等电子体的是CO2,因此和CO2类似,N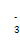 的空间构型为直线形,仿照
的空间构型为直线形,仿照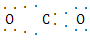 可得电子式为
可得电子式为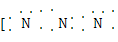 ]-。
]-。
(3)形成原子晶体的原子半径越小,共价键越强,硬度越大。碳原子半径小于硅原子半径,所以二氧化硅的硬度小。
(4)①根据构造原理可知,基态W2+的价电子排布式为3d6。
②根据晶胞结构可知,含有铁原子是1+8×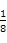 =2,碳原子是2×
=2,碳原子是2×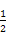 +4×
+4× =2,所以化学式是FeC。
=2,所以化学式是FeC。

练习册系列答案
相关题目