题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g)ΔH=+133kJ·mol-1
H2O(g)=H2O(l) ΔH=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:____________。
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H—H键断裂
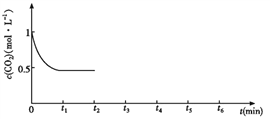
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。_____________
⑵改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______K(II)(填“﹥”“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”“逆向”或“不”)。
⑶利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,
装置如图所示:
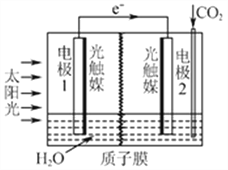
①电极2的电极反应式是____________;
②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”______g。
【答案】 4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H=-1100.2kJ·mol-1 低温 d e 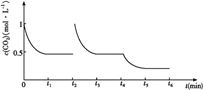 < < 0.025 mol·L-1 ·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9
< < 0.025 mol·L-1 ·min-1 < 不 CO2+2H++2e-=HCOOH 减少 9
【解析】本题考查化学平衡状态的判断,盖斯定律的应用,平衡移动的应用,燃料电池的应用,电极式的书写。
I、根据氢气的热值可书写氢气的热化学方程式是2H2(g)+ O2(g)=H2O(l) △H=-142.9×4kJ/mol=-571.6kJ/mol,根据盖斯定律,将已知热化学方程式中的氧气与液态水消去得到H2还原NO2生成水蒸气和氮气的热化学方程式,为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ·mol-1;
II、(1)①该反应的△S<0,所以若反应自发进行,则△H<0,因此反应自发进行的条件是低温自发;
② a、该体系中的气体只有二氧化碳和氢气,且二者的起始物质的量之比等于化学方程式中的化学计量数之比,所以混合气体的平均式量始终不变,不能判断为平衡状态,错误;
b、二氧化碳与氢气始终是1:3的关系,所以CO2和H2的体积分数保持不变的状态不是平衡状态,错误;
c、二氧化碳与氢气的起始物质的量之比等于化学方程式中的化学计量数之比,所以二者的转化率一定相等,与是否达到平衡状态无关,错误;
d 、因为该体系中有液体参加,所以气体的质量在逐渐减少,则气体的密度减小,达平衡时,保持不变,正确;
e、1mol CO2生成的同时有3mol H-H键断裂,符合正逆反应速率相等,是平衡状态,答案选de;
③在t2时将容器容积缩小一倍,二氧化碳的浓度瞬间增大到1mol/L,则压强增大,平衡正向移动, t3时达到平衡,达到的平衡与原平衡相同,浓度仍是0.5mol/L;该反应是放热反应,t4时降低温度,则平衡正向移动,t5时达到平衡,则二氧化碳的浓度将小于0.5mol/L,对应的图像为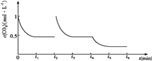 。
。
(2)①因为生成甲醇的反应是放热反应,而反应II是从逆反应开始的,所以反应吸热,所以绝热容器的温度要低于恒温容器,即反应I温度高于反应II,温度升高,放热反应的平衡常数减小,则K(I)<K(II);二者都是恒容条件,若是恒温恒容,二者达到的平衡是等效平衡,甲醇的浓度相同,而反应I温度高于反应II,所以反应II需再降低温度,而温度降低,平衡正向移动,则甲醇的浓度增大,平衡时CH3OH的浓度c(I)<c(II);
②对反应I,前10min内氢气的物质的量减少6-4.5=1.5mol,则甲醇的物质的量增加0.5mol,所以前10min内平均反应速率v(CH3OH)=0.5mol/2L/10min="0.025mol" ·L-1·min-1;30min时是平衡状态,生成甲醇1mol,则消耗氢气3mol,平衡氢气的物质的量是3mol,而改变温度后氢气的物质的量变为3.2mol,物质的量增大,说明平衡逆向移动,因为该反应是放热反应,所以升高温度,平衡逆向移动,则T1<T2;若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),根据表中数据计算该温度下的平衡常数为K=1/6.75,此时Qc=1/6.75=K,所以平衡不移动。
(3)离子交换膜为质子膜,则电解质溶液呈酸性,根据总的电池反应为2H2O + 2CO2 ═ 2HCOOH + O2可知,该反应中C元素化合价由+4价变为+2价,O元素化合价由-2价变为0价,所以1是负极、2是正极,(也可根据装置图中电子的流向判断1是负极、2是正极),负极上水失电子生成氢离子和氧气,判断电极1电极反应:2H2O-4e-═ O2+4H+,酸性增强,H+通过质子膜进入到电极2区域;电极2通入二氧化碳,酸性条件下生成HCOOH,电极反应:CO2+2H++2e-═HCOOH,酸性减弱, 从总反应看,每消耗1molCO2,就会消耗1molH2O,现有标准状况下, 11.2L CO2即0.5mol反应,那就会消耗0.5molH2O即9g。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案