题目内容
【题目】甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中的两种组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,其相对分子质量与空气中某种主要成分的相对分子质量相等;乙和丙是铜的两种常见氧化物,乙是新制氢氧化铜与乙醛反应的还原产物.试回答下列问题:
(1)甲的结构式 .
(2)甲是一种二元弱碱,则甲与过量硫酸反应的产物为(写化学式).16g甲在空气中充分燃烧,生成一种常见液态物质和氮气,放出311kJ热量,则其热化学方程式为 .
(3)甲和丙反应的产物中含有乙和一种气态单质,写出其化学方程式 .
(4)向乙的固体中加入过量硫酸酸化的硫酸铁溶液,乙固体完全溶解,得到透明溶液.
①写出其离子方程式 .
②若所得溶液中阳离子浓度均约为0.1mol/L,再向所得混合溶液中加丙,最先得到沉淀(不同浓度的阳离子开始和完全以氢氧化物沉淀的pH如图).
③向上述混合液中加入有机萃取剂(RH)发生反应:2RH(有机相)+Cu2+(水相)R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶.请设计实验方案,验证有机相中含有铜元素 . 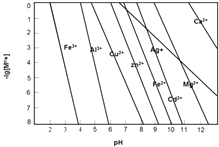
【答案】
(1)
(2)N2H6SO4;N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣622kJ/mol
(3)N2H4+4CuO=2Cu2O+N2↑+2H2O
(4)Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O;Fe(OH)3;取有机层,加入盐酸或稀硫酸,振荡后水层呈蓝色,则证明有机相中含有铜元素
【解析】解:甲、乙、丙三种化合物均由氢、氮、氧、铜四种元素中两种元素组成.常温下,甲是一种含氮质量分数为87.5%的液态化合物,相对分子质量与空气中某种主要成份的相对分子质量相同,而空气的主要成分为氧气和氮气,如为氮气,则相对分子质量为28,没有符合物质,如为氧气,则相对分子质量为32,则该化合物含N的质量为32×87.5%=28,则甲含有N、H两种元素,分子式为N2H4 , 乙和丙是铜的两种常见氧化物,乙是新制的氢氧化铜与乙醛反应的还原产物,则乙为Cu2O,丙为CuO.(1)甲为N2H4 , 结构式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)肼是一种二元碱,则可以与2个H+结合,N2H4与硫酸反应的方程式为:N2H4+H2SO4=N2H6SO4 , 则产物为N2H6SO4 , n(N2H4)=
;(2)肼是一种二元碱,则可以与2个H+结合,N2H4与硫酸反应的方程式为:N2H4+H2SO4=N2H6SO4 , 则产物为N2H6SO4 , n(N2H4)= ![]() =0.5mol,燃烧时生成一种常见液态物质和氮气,液态物质为生成水,放出311kJ热量,则热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣622kJ/mol,所以答案是:N2H6SO4;N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣622kJ/mol;(3)甲和丙反应的产物中含有乙和一种气态单质,该气体单质为氮气,反应的方程式为:N2H4+4CuO=2Cu2O+N2↑+2H2O,所以答案是:N2H4+4CuO=2Cu2O+N2↑+2H2O;(4)向Cu2O固体中加入过量硫酸酸化的硫酸铁溶液,Cu2O固体完全溶解,得到透明溶液,应生成硫酸铜和硫酸亚铁,①反应的离子方程式为:Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O,所以答案是:Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O;
=0.5mol,燃烧时生成一种常见液态物质和氮气,液态物质为生成水,放出311kJ热量,则热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣622kJ/mol,所以答案是:N2H6SO4;N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣622kJ/mol;(3)甲和丙反应的产物中含有乙和一种气态单质,该气体单质为氮气,反应的方程式为:N2H4+4CuO=2Cu2O+N2↑+2H2O,所以答案是:N2H4+4CuO=2Cu2O+N2↑+2H2O;(4)向Cu2O固体中加入过量硫酸酸化的硫酸铁溶液,Cu2O固体完全溶解,得到透明溶液,应生成硫酸铜和硫酸亚铁,①反应的离子方程式为:Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O,所以答案是:Cu2O+2Fe3++2H+=2Cu2++2Fe2++H2O;
②反应后硫酸铁过量,由图象可知Fe3+完全沉淀时所需pH较小,则加入CuO消耗氢离子时,溶液pH不断增大,首先析出的沉淀是Fe(OH)3 , 所以答案是:Fe(OH)3;
③由可逆反应2RH(有机相)+Cu2+(水相)R2Cu(有机相)+2H+(水相)可知,可在有机相中加入盐酸或稀硫酸,则平衡向逆向移动,如溶液变成蓝色,可说明有机相中含有Cu2+ , 所以答案是:取有机层,加入盐酸或稀硫酸,振荡后水层呈蓝色,则证明有机相中含有铜元素.

