题目内容
(2012?长宁区一模)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
分析:A、铝是两性元素和强酸、强碱反应生成氢气;
B、甲基橙呈黄色溶液P溶液PH>4.4,溶液可能是酸、中性、碱;
C、氢离子浓度c(H+)=1.0×10-13mol/L,说明溶液呈碱性;
D、硝酸根在酸溶液中具有氧化性能氧化亚铁离子.
B、甲基橙呈黄色溶液P溶液PH>4.4,溶液可能是酸、中性、碱;
C、氢离子浓度c(H+)=1.0×10-13mol/L,说明溶液呈碱性;
D、硝酸根在酸溶液中具有氧化性能氧化亚铁离子.
解答:解:A、与铝反应产生大量氢气的溶液可能是酸溶液或碱溶液:Na+、K+、CO32-、NO3-,酸溶液中碳酸根离子不能大量存在,故A不符合;
B、甲基橙呈黄色溶液P溶液PH>4.4,溶液可能是酸、中性、碱;在酸溶液中AlO2-不能大量存在,故B不符合;
C、c(H+)=1.0×10-13mol/L溶液,依据离子积常数计算可知溶液呈碱性,C6H5O-、K+、SO42-、Br-,离子可以大量存在,故C符合;
D、1.0 mol?L-1的KNO3溶液存在硝酸根离子,H+、Fe2+、Cl-、SO42-在酸溶液中的Fe2+离子被氧化,不能存在,故D不符合;
故选C.
B、甲基橙呈黄色溶液P溶液PH>4.4,溶液可能是酸、中性、碱;在酸溶液中AlO2-不能大量存在,故B不符合;
C、c(H+)=1.0×10-13mol/L溶液,依据离子积常数计算可知溶液呈碱性,C6H5O-、K+、SO42-、Br-,离子可以大量存在,故C符合;
D、1.0 mol?L-1的KNO3溶液存在硝酸根离子,H+、Fe2+、Cl-、SO42-在酸溶液中的Fe2+离子被氧化,不能存在,故D不符合;
故选C.
点评:本题考查了离子共存的分析判断,离子性质和环境的判断是解题依据,关键注意硝酸根离子在酸溶液中的氧化性判断,题目难度中等.

练习册系列答案
相关题目
 (2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )
(2012?长宁区一模)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘少.下列说法正确的是( )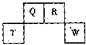 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:






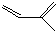
 的分子式为
的分子式为
 以及必要的无机试剂可合成
以及必要的无机试剂可合成 ,写出第一步合成反应的化学方程式
,写出第一步合成反应的化学方程式
 的一种同分异构体A,它的一氯代物有三种.与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为
的一种同分异构体A,它的一氯代物有三种.与Br2按1:1加成产物只有一种(不考虑顺反、立体异构),则A的结构简式为
 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.

 )是一种医药中间体.
)是一种医药中间体.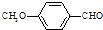 )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内.并写出茴香醛与银氨溶液反应的化学方程式.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭号下方,试剂或原料写在箭号上方,中间产物填在下图中的方框内.并写出茴香醛与银氨溶液反应的化学方程式.


 (2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.