题目内容
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性.试用离子方程式表示:
①盐碱地产生碱性的原因
②用石膏降低其碱性的原理
(2)根据下列2个热化学反应方程式:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ/mol;
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol.
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
(3)常温下,等物质的量的浓度的①氨水;②NH4HSO4;③NH4Cl;④(NH4)2CO3;⑤(NH4)2SO4溶液中,c(N
)由大到小的顺序为
①盐碱地产生碱性的原因
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
②用石膏降低其碱性的原理
CO32-+CaSO4═SO42-+CaCO3
CO32-+CaSO4═SO42-+CaCO3
(2)根据下列2个热化学反应方程式:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ/mol;
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol.
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5kJ/mol
Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5kJ/mol
.(3)常温下,等物质的量的浓度的①氨水;②NH4HSO4;③NH4Cl;④(NH4)2CO3;⑤(NH4)2SO4溶液中,c(N
| H | + 4 |
⑤
⑤
>④
④
>②
②
>③
③
>①
①
(填序号).分析:(1)①碳酸根离子水解显碱性,导致盐碱地产生碱性;
②石膏能与碳酸根离子反应,降低碱性;
(2)①FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ/mol;
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol,
由盖斯定律可知①×3+②得Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g);
(3)假设浓度均为1mol/L,④⑤接近2mol/L,但④中离子相互促进水解;②③接近1mol/L,但②中氢离子抑制铵根离子水解;氨水中一水合氨电离产生铵根离子,则浓度最小.
②石膏能与碳酸根离子反应,降低碱性;
(2)①FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ/mol;
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol,
由盖斯定律可知①×3+②得Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g);
(3)假设浓度均为1mol/L,④⑤接近2mol/L,但④中离子相互促进水解;②③接近1mol/L,但②中氢离子抑制铵根离子水解;氨水中一水合氨电离产生铵根离子,则浓度最小.
解答:解:(1)①碳酸根离子水解显碱性,导致盐碱地产生碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
②石膏能与碳酸根离子反应,降低碱性,离子反应为CO32-+CaSO4═SO42-+CaCO3,
故答案为:CO32-+CaSO4═SO42-+CaCO3;
(2)①FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ/mol;
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol,
由盖斯定律可知①×3+②得Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)
△H=(-218kJ/mol)×3+640.5kJ/mol=-13.5kJ/mol,
故答案为:Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5kJ/mol;
(3)假设浓度均为1mol/L,④⑤接近2mol/L,但④中离子相互促进水解,则⑤>④;②③接近1mol/L,但②中氢离子抑制铵根离子水解,则②>③;氨水中一水合氨电离产生铵根离子,则浓度最小,所以铵根离子浓度为⑤>④>②>③>①,故答案为:⑤;④;②;③;①.
故答案为:CO32-+H2O?HCO3-+OH-;
②石膏能与碳酸根离子反应,降低碱性,离子反应为CO32-+CaSO4═SO42-+CaCO3,
故答案为:CO32-+CaSO4═SO42-+CaCO3;
(2)①FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ/mol;
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ/mol,
由盖斯定律可知①×3+②得Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)
△H=(-218kJ/mol)×3+640.5kJ/mol=-13.5kJ/mol,
故答案为:Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=-13.5kJ/mol;
(3)假设浓度均为1mol/L,④⑤接近2mol/L,但④中离子相互促进水解,则⑤>④;②③接近1mol/L,但②中氢离子抑制铵根离子水解,则②>③;氨水中一水合氨电离产生铵根离子,则浓度最小,所以铵根离子浓度为⑤>④>②>③>①,故答案为:⑤;④;②;③;①.
点评:本题为综合题,涉及盐类水解、离子反应方程式的书写、盖斯定律计算反应热、离子浓度的比较,注重常考考点的考查,题目难度中等,(3)为解答的难点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?成都模拟)溶液中的化学反应大多是离子反应.根据要求回答下列问题.
(2012?成都模拟)溶液中的化学反应大多是离子反应.根据要求回答下列问题. ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有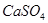 ,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释
,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释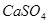 的作用 。
的作用 。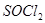 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将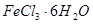 混合并加热,可得到无水
混合并加热,可得到无水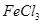 ,得到无水
,得到无水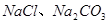 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有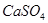 ,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释
,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释 的作用
。
的作用
。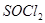 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将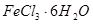 混合并加热,可得到无水
混合并加热,可得到无水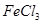 ,得到无水
,得到无水