题目内容
【题目】下列依据热化学方程式得出的结论正确的是![]()
A.已知![]()
![]() ,则含
,则含![]() gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于
gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于![]()
B.已知![]()
![]() ,则标况下1mol氢气完全燃烧放出
,则标况下1mol氢气完全燃烧放出![]() kJ的热量
kJ的热量
C.已知![]()
![]() ,
,![]()
![]() ,则
,则![]()
D.已知P![]() 白磷,
白磷,![]()
![]() 红磷,
红磷,![]() ,则白磷比红磷稳定
,则白磷比红磷稳定
【答案】A
【解析】
A.中和热是指稀的强酸和强碱溶液发生中和反应生成1mol水时所放出的热量,醋酸是弱酸,其电离过程是吸热过,![]() 即1molNaOH的稀溶液与稀醋酸完全中和,放出小于
即1molNaOH的稀溶液与稀醋酸完全中和,放出小于![]() kJ的热量,故A正确;
kJ的热量,故A正确;
B.根据热化学方程式,2mol氢气燃烧生成气态水放出483.6kJ的热量,则1mol氢气燃烧生成气态水放出241.8kJ的热量,标况下水不是气体,所以标况下1mol氢气完全燃烧放出的热量不是241.8kJ,故B错误;
C.焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即![]() ,故C错误;
,故C错误;
D.P ![]() 白磷,
白磷,![]()
![]() 红磷,
红磷,![]() ,所以红磷的能量低于白磷的能量,所以白磷不如红磷稳定,故D错误。
,所以红磷的能量低于白磷的能量,所以白磷不如红磷稳定,故D错误。
故选:A。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
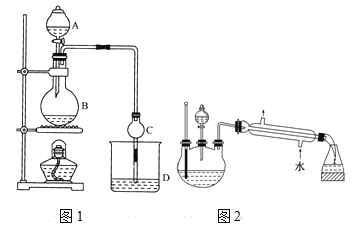
请回答:
(1)浓硫酸的作用是____;用同位素18O示踪法确定反应产物水分子中氧原子的提供者,若用18O标记乙醇分子中的氧原子,请写出该化学方程式:________。
(2)球形干燥管C的作用是_______。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是_______。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出________;再加入无水硫酸钠除去水,然后进行________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)________。
(6)该实验中用30g乙酸与46g乙醇反应,如果实际得到的乙酸乙酯的质量是26.4g,则该实验中乙酸乙酯的产率是______。(产率指的是某种生成物的实际产量与理论产量的比值。已知乙醇、乙酸、乙酸乙酯的相对分子质量分别为:46、60、88)




